
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
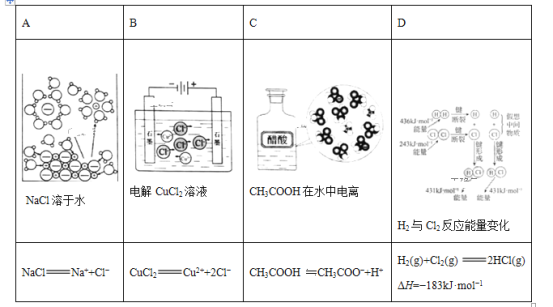
A.AB.BC.CD.D
【答案】B
【解析】
A. NaCl为强电解质,NaCl溶于水,NaCl在水分子作用下,自发解离为Na+和Cl-,故电离方程式为NaCl=Na++Cl-,示意图与化学用语表述内容相符;
B. 电解氯化铜溶液,铜离子向阴极移动,得电子,发生电极反应为:Cu2++2e-=Cu,氯离子向阳极移动,失电子,发生电极反应为:2Cl-+2e-=Cl2,所以电解总反应为:Cu2++2Cl-![]() Cu+Cl2↑,示意图与化学用语表述内容不相符;
Cu+Cl2↑,示意图与化学用语表述内容不相符;
C. CH3COOH为弱电解质,溶于水部分电离,因此电离方程式为CH3COOH![]() CH3COO-+H+,示意图与化学用语表述内容相符;
CH3COO-+H+,示意图与化学用语表述内容相符;
D. 由图可知,反应H2(g)+Cl2(g)=2HCl(g)的反应热等于断裂反应物分子中的化学键吸收的总能量(436kJ/mol+243kJ/mol=679kJ/mol),与形成生成物分子中化学键放出的总能量(431kJ/mol×2=862kJ/mol)之差,即放热183kJ/mol,放热H为负值,所以H2(g)+Cl2(g)=2HCl(g) H=-183kJ/mol,示意图与化学用语表述内容相符;
综上所述,B项符合题意,
答案选B。


科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
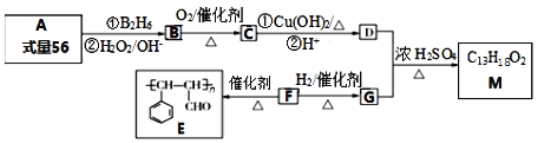
已知:(1)A是含一个支链的烃;
(2)R-CH=CH2 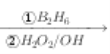 R-CH2CH2OH。
R-CH2CH2OH。
请回答下列问题:
(1)有机物A的系统命名为_______________。
(2)F中官能团的名称为:______________;F与新制的氢氧化铜悬浊液反应的化学方程式:________。
(3)D+G→ M的反应方程式为_____________。
(4)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体。X中满足与FeCl3溶液反应显紫色,其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1:1:2:6的结构简式为_________。
(5)参照M的合成路线,设计一条由丙烯为起始原料制备丙酸丙酯的合成路线无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
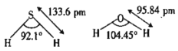
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
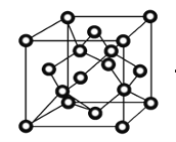
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应,理由是__________。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的反应往往伴随副反应发生,因此需要分离提纯。有一种水果香精的合成步骤如下:
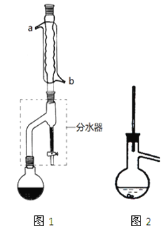
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式____________。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、_________、___________。
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________________杂质。
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在_______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com