
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�顣
ʵ��I����Ӧ����Ķ���̽��,����ͼװ��(�̶�װ������ȥ)����ʵ�飺
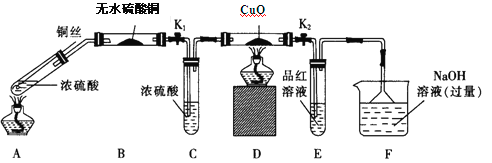
��1��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ��_____________��Bװ���е�������__________��
��2��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������_________��
��3��ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ�������_________��
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ���������_________��
ʵ��������Ӧ����Ķ���̽��
��5����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4=cCu2S��dCuSO4��eH2O����a��b=______
��6��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250��00 mL��Һ��ȡ����Һ25��00 mL�������� KI��Һ�����Ե�����ҺΪָʾ������0.36 mol��L-1��Na2S2O3��Һ�ζ����ɵ�I2��3��ʵ��ƽ�����ĸ�Na2S2O3��Һ25��00 mL������Ӧ����ͭ������Ϊ6��4 g��������ͭ�IJ���Ϊ___��
(��֪![]() )
)
���𰸡�SO2+2OH-=SO32-+H2O ��ˮ����ͭ��ˮ���� Dװ��������ͭ��ɫ�ޱ仯��Eװ����Ʒ����Һ��ɫ ����ͭ˿���ر�K1��K2 ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ���� 5:4 90%
��������
��1��F����NaOH��Һ���ն����SO2���巢�������ӷ�Ӧ����ʽΪSO2+2OH-=SO32-+H2O��B����ˮ����ͭ��ˮ������
��2������A�з�Ӧ��������з��������D���к�ɫ�仯Ϊ��ɫ������֤��A���������ɣ�ͬ��E��Ʒ����ɫ֤��A�����ɶ���������ôDװ��������ͭ��ɫ���仯��Eװ����Ʒ����Һ��ɫ�����˵�������˶������������û����������֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ء�
��3��ʵ�����ʱ����ȥ���оƾ���֮ǰΪ��ֹ��������SO2������ͭ˿��Ϊ�������ر�K1��K2 ��
��4����֤���ɵ���Һ�к�Cu2+����ȴ��A����Һ����ʢˮ���ձ��й۲��Ƿ������ɫ����������ɫ��Һ֤������Cu2+��
��5����������ԭ��Ӧ�е����غ���ƽ��ѧ����ʽ�ɵ�a:b=5:4��
��6��n(Na2S2O3)=0.025L��0.36mol/L=0.009mol
����������ͭ�����ʵ���Ϊn,�ɷ�Ӧ![]()
��Cu��+----2 S2O3��-
2 2
n 0.009mol��250/25
���n��0.09mol��6.4gͭ��ȫת��Ϊ����ͭ�����ʵ���Ϊ6.4g/64g��mol-1=0.1mol����������ͭ����Ϊ90%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL KNO3��Cu(NO3)2�Ļ����Һ�У�c(NO3-)��6 mol/L����ʯī�缫������Һ����ͨ��һ��ʱ����������ռ���22.4 L����(��״��)���ٶ�������Һ�����Ϊ500 mL������˵����ȷ����
A. ���õ���Cu�����ʵ���Ϊ0.5 mol
B. ��������Һ�м���98 g��Cu(OH)2�ɻָ�Ϊԭ��Һ
C. ԭ�����Һ��c(K��)��4 mol/L
D. ������Һ��c(H��)��2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����������Ļ�����壬����ȼ�����ȼ�գ�Ȼ��������ȴ������ 200mL 4.00mol��L-1 �� NaOH ��Һǡ����ȫ���գ������Һ�к��� ClO-�����ʵ���Ϊ 0.1mol��
��1��������Һ�� Cl-�����ʵ���Ϊ_________mol��
��2��ԭ������������������������ʵ�����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б���ʽ�������
A. ����ĵ���ʽ��![]()
B. ̼ԭ�ӵ�L����ӹ����ʾʽ��![]()
C. �����ӵĺ�������Ų�ʽ��1s22s22p63s23p6
D. ̼��12ԭ�ӣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Բ���A������Ԫ����ɣ�Ϊ̽������ɺ����ʣ���Ʋ��������ʵ�飺

(1) A�Ļ�ѧʽΪ______��
(2) �û�ѧ����ʽ��������C����ˮ��Ӧ����D�Ĺ��̣�________��
(3) B������������ɵ�����F�����ھ�ˮ����ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ʵ����̻���ʵ�ķ�Ӧ����ʽ����ȷ����
A. �����ռ�ʱ������ʹ����ͨʯӢ������SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B. �ں����ҵĽ���Һ(����I-)�еμ�H2O2�õ�I2:2I-+ H2O2+2H+= I2+O2��+2H2O
C. ���ȵ���˿��ˮ�Ӵ��������γ�����ɫ�����ɫ�������㣺3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D. ��84����Һ������Ч�ɷ�NaClO�����������������Ҫ�ɷ����ᣩ���ʹ�÷ų�������ClO-+ Cl-+ 2H+= Cl2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����ڵ�����,��ѡ�õ��Լ�������ȷ����
A. Na2CO3��Һ(NaHCO3),ѡ��������NaOH��Һ
B. NaHCO3��Һ(Na2CO3),Ӧͨ�������CO2����
C. Na2O2��ĩ(Na2O),��������������м���
D. Na2CO3��Һ(Na2SO4),��������Ba(OH)2��Һ,����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Թ�A���ȼ���46 g CH3CH2OH����ҡ����������2 mLŨ���Ტ���ҡ�ȣ���ȴ���ټ���30 g CH3COOH����ֻ�Ϻ��Թ̶ܹ�������̨�ϣ����Թ�B�м���7mL C��Һ�����Ӻ�װ���þƾ��ƶ��Թ�A���ȣ����۲쵽�Թ�B������������ʱֹͣ���ȡ�
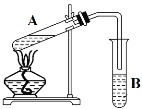
(1)Ũ�����������__________
(2)Bװ���й۲쵽��������______
(3)��ҺCΪ_________�� B�е���δ����Һ�����£���ԭ����__________
A ����NaOH��Һ b ˮ c ����Na2CO3��Һd CCl4
(4)���ͨ�������ᴿ�õ��������� 30.8 g ��������������ʵ�ʲ�����____(ʵ�ʲ��� = ![]() ��100%)
��100%)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����ܱ������н��еķ�Ӧ��A��s����3B��g��![]() 2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
B. C ( s) + H2O (g) ![]() CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
C. N2(g) + 3H2(g)![]() 2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
D. A(g)+ 3B (g) ![]() 2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����
2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����![]() ����
����![]() ����ǰ�߱Ⱥ��߿�
����ǰ�߱Ⱥ��߿�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com