
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙炔和氯气的加成反应 | ||
| C. | 甲苯与等物质的量的Br2发生反应 | D. | 乙烯与水的加成反应 |
分析 A.甲烷光照下的取代反应为连锁式反应;
B.乙烯与氯化氢只能以1:1加成;乙炔中含碳碳三键,氯气的量不同,产物不同;
C.甲苯苯环上的H均可被取代;
D.乙炔中含碳碳三键,氯气的量不同,产物不同.
解答 解:A.甲烷与Cl2在光照条件下发生取代反应可得到各种氯代产物和氯化氢,故A不选;
B.乙炔与Cl2加成反应可以得到CHCl═CHCl或CHCl2CHCl2,故B不选;
C.甲苯与等物质的量的Br2发生反应时,甲苯苯环和甲基上的氢原子均可被取代,产物不只一种,故C不选;
D.乙烯与水以1:1加成,只有一种乙醇,故D选;
故选D.
点评 本题考查有机物的反应,为高频考点,把握取代反应、加成反应的特点为解答的关键,侧重甲烷、乙烯、甲苯、乙炔性质的考查,题目难度不大.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 在0.1 mol•L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取Na2CO3的质量 26.5(g) | 应选用容量瓶的规格 250mL(mL) | 除容量瓶外还需要的其它玻璃仪器是上图中的烧杯、胶头滴管及玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L乙醛完全燃烧后,生成CO2的分子数为2NA | |
| B. | 1L 0.1mol/L乙酸溶液中所含乙酸分子数为0.1NA | |
| C. | 常温常压下,14g乙烯、丙烯、丁烯的混合气体所含原子总数为3NA | |
| D. | 1mol甲基所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
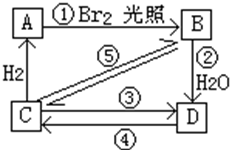 (1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
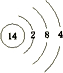 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式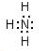 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com