
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)A、B、C三种元素的名称分别为________、________、________。
(2)B位于元素周期表中第________周期,第________族。
(3)C的单质与H2反应的化学方程式为_________
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式________
【答案】 氮 硫 氟 三 ⅥA F2+H2![]() 2HF 2NH3+H2SO4
2HF 2NH3+H2SO4![]() (NH4)2SO4
(NH4)2SO4
【解析】A、B、C为短周期元素,根据元素在周期表中位置知,A和C位于第二周期、B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等,则x-9+x-7=x,则x=16,所以B是S元素,则A是N元素、C是F元素。
(1)通过以上分析知,A、B、C分别是氮、硫、氟元素,故答案为:氮;硫;氟;
(2)B是S元素,S原子核外有3个电子层、最外层电子数是6,所以S元素位于第三周期第VIA族,故答案为:三;ⅥA;
(3)C为F元素,氟与H2反应的化学方程式为F2+H2=2HF,故答案为:F2+H2=2HF;
(4)A的气态氢化物为氨气,氨气与硫酸反应的化学方程式为2NH3+H2SO4=(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4。


科目:高中化学 来源: 题型:
【题目】已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是
A. 16 g B. 32 g C. 64 g/mol D. 32 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
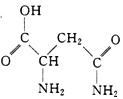
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有 种。
(3)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3 | -60.75 |
H2Se | 1.47 | 91.0 | -41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/KJ·mol-1 | I6/KJ·mol-1 | I7/KJ·mol-1 | I8/KJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述不正确的是
A.72g SiO2晶体含4.8NA个σ键
B.1mol[Cu(NH3)4]2+中含4NA配位键
C.在2.4g石墨中,含C-C共价键数目为0.3NA
D.CO和N2等电子体,22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
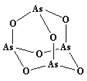
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
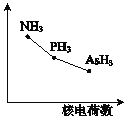
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
B. 催化裂化不仅可以提高汽油的产量,而且可以提高汽油的质量
C. 裂化汽油可使溴水褪色
D. 裂解的目的是获得乙烯、丙烯、丁二烯等短链不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015浙江理综化学】Ⅰ.请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 食盐是常用的调味剂和防腐剂
B. 淀粉在人体中最终水解为葡萄糖而被吸收
C. 多吃含钙丰富的豆腐可预防骨质疏松
D. 多吃富含维生素A的鱼肝油可预防坏血病
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com