
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料高温 | |
| B. | 二氧化硅能与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 光纤通信的光导纤维是由硅晶体经特殊工艺制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
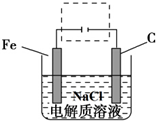 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ②③⑤⑥ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 | |
| B. | 用CO2可以鉴别NaAlO2溶液和CH3COONa溶液 | |
| C. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| D. | 用BaCl2可以溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 常温常压下,32gO2含有的O原子数为NA | |
| C. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4L 甲烷和乙炔的混合气体所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
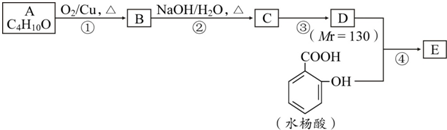

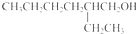 .
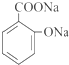
.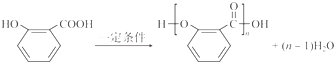 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com