
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标准状况下,22.4 L H2O所含的分子数为NA
B. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 常温常压下8g O3中含有8NA个电子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为_____,氧原子数之比为_____,相同条件下(同温同压)的体积之比为_____,密度之比为_____。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是_____,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)用2.4 mol·L-1的H2SO4溶液配制100 mL浓度为0.2 mol·L-1的稀硫酸,需量取2.4 mol·L-1的H2SO4溶液的体积是_____mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度_____;
②定容时俯视刻度线,使所配溶液浓度_____;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2(g)2NH3(g)反应过程的能量变化如图所示:已知1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1molN﹣H键时释放390.8kJ的能量.

①图中E的大小对该反应热有无影响?____________________________.该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?______________________,理由_________________.
②图中△H=___kJ/mol.
③如果反应速率v(H2)为0.15mol/(Lmin),则v(N2)=_____________mol/(Lmin),v(NH3)=_________________________________________.
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(l) △H=﹣19.5kJmol﹣1
N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=﹣534.2kJmol﹣1
请写出肼和 N2O4反应的热化学反应方程式_______________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
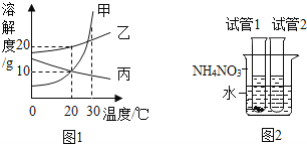
A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaOH的摩尔质量为:__________ 。
(2)24.5克H2SO4的物质的量为:___________。
(3)标况下,8.96LCO2的质量为:___________。
(4)含3.01×1023个N原子的NH3在标况下的体积为:_____________ 。
(5)3g金属锌与足量的稀硫酸反应可生成标况下的氢气体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
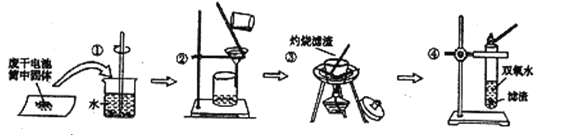
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,下列叙述中不正确的是( )
A. 0.1 mol/L 的 CH3COOH 溶液中加水稀释,溶液中所有离子浓度均减小
B. 醋酸溶液中离子浓度的关系满足:c(H+) = c(CH3COO-) + c(OH- )
C. CH3COOH 溶液中加入少量 CH3COONa(s),平衡逆向移动
D. 常温下,pH = 2 的 CH3COOH 溶液与 pH = 12 的 NaOH 溶液等体积混合后,溶液的 pH < 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com