
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
分析 A.加入400mL水,溶液体积不是500mL;
B.稀释前后溶质的物质的量不变;
C.200 mL5mol/LH2SO4中氢离子的物质的量为0.2mL×5mol/L×2=2mol,结合c=$\frac{n}{V}$计算;
D.稀释前后溶质的物质的量不变.
解答 解:A.加入400mL水,溶液体积不是500mL,不能计算稀释后的浓度,故A错误;
B.稀释前后溶质的物质的量不变,则500mL溶液中c (H+)=$\frac{0.2L×5mol/L}{0.5L}$=2mol/L,故B正确;
C.200 mL5mol/LH2SO4中氢离子的物质的量为0.2mL×5mol/L×2=2mol,500mL溶液中c (H+)=$\frac{2mol}{0.5L}$=4mol/L,故C错误;
D.稀释前后溶质的物质的量不变,则500mL溶液中c (H+)=$\frac{0.1L×5mol/L}{0.5}$=1mol/L,故D错误;
故选B.
点评 本题考查溶液配制及物质的量浓度的计算,为高频考点,把握体积、浓度、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意溶液体积的判断,题目难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
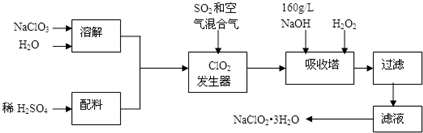
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.
A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③⑦⑧⑥ | B. | ②③⑦⑤⑥ | C. | ①③⑧⑥⑦ | D. | ②⑥③⑦⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:SO32-、Cl-、NO3-、Na+ | |
| B. | 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+ | |
| C. | 在1 mol•L-1的NaAlO2溶液中:K+、Ba2+、SO42-、OH- | |
| D. | 在1 mol•L-1的AlCl3溶液中:NH4+、Ag+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com