
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示![]() 或
或![]() ]与
]与![]() 的关系如图所示。已知碳酸
的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]() 。则下列说法正确的是
。则下列说法正确的是
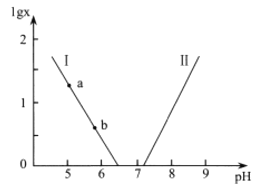
A.曲线![]() 表示lg(
表示lg(![]() )与
)与![]() 的变化关系
的变化关系
B.![]() 的过程中,水的电离程度逐渐减小
的过程中,水的电离程度逐渐减小
C.当![]() 时
时![]()
D.当![]() 增大时,
增大时,![]() 逐渐减小
逐渐减小
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_______作指示剂。
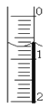
(3)读取盛装0.1000 mol/L NaOH 溶液的____________(填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为__________mL。
(4)滴定。当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=__________g/100mL
(2)在本实验滴定过程中,下列操作会使结果偏大的是 _________
a.碱式滴定管在滴定时未用标准氢氧化钠溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
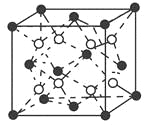
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是

A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:
元素 | A | B | C |
结构信息 | 基态原子核外有两个电子层,最外层有3个未成对电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.
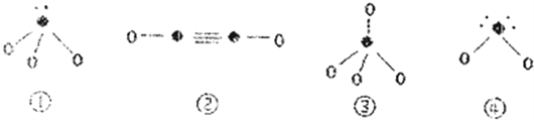
在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:
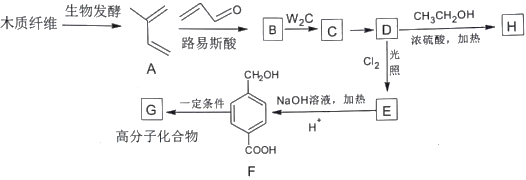
已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,回答下列问题:
CH2=CH2↑+H2O,回答下列问题:
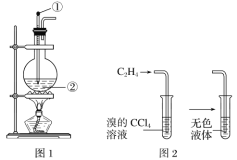
(1)图1中仪器①、②的名称分别为______、______。
(2)收集乙烯气体最好的方法是______。
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_____(填反应类型),若将反应后无色液体中的反应产物分离出来,则宜采用的方法是_____。
II.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请回答下列问题:
(4)甲同学的实验中有关的化学方程式为______。
(5)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是_____(填字母)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质就是乙烯
(6)乙同学推测此乙烯中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是___。在验证过程中必须全部除去,除去该杂质的试剂可选用______。
(7)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取方法有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的冶炼根据金属的活动性不同,可以采用不同的冶炼方法,以下不是金属冶炼方法的是
A.2HgO![]() 2Hg+O2↑
2Hg+O2↑
B.2NaCl(熔融) ![]() 2Na+Cl2↑
2Na+Cl2↑
C.SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
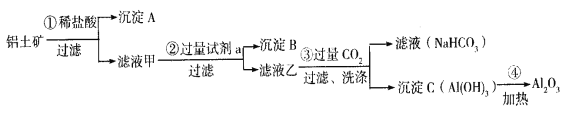
①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
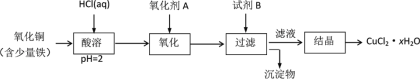
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂最好选用__________(填编号)。
A.KMnO4 B.HNO3 C.Cl2
②写出“酸溶”时主要的离子方程式__________________________
③从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却结晶 D. 蒸发浓缩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com