
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
(1)Fe2++S2O32—+S+H2O FeS2+2H++SO42—
FeS2+2H++SO42—
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) ΔH=-3 408 kJ·mol-1
[或FeS2(s)+ O2(g)=
O2(g)= Fe2O3(s)+2SO2(g)] ΔH=-852 kJ·mol-1
Fe2O3(s)+2SO2(g)] ΔH=-852 kJ·mol-1
(4)解:120n(FeS2)+88n(FeS)=1.120 0
n(FeS2)+n(FeS)=
n(FeS2)=0.007 5 mol
w(FeS2)= ≈0.803 6
≈0.803 6
【解析】 (1)由题中信息可写出四种反应物,再由原子守恒和电荷守恒写出产物,Na2S2O3中一个S显+6价,一个S显-2价,其中-2的S与单质S发生归中反应,根据得失电子守恒配出反应。(2)检验SO42—,需要先用盐酸除去干扰离子,以防生成除BaSO4以外的钡盐沉淀。(3)0.01 mol FeS2完全燃烧放出8.52 kJ的热量。写热化学方程式要标注物质的状态,同时ΔH应与化学计量系数成比例。(4)由质量关系,列出120n(FeS2)+88n(FeS)=1.120 0,由铁原子守恒列出n(FeS2)+n(FeS)= mol,联合解得FeS2的物质的量,进而求出其含量。
mol,联合解得FeS2的物质的量,进而求出其含量。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
下图是某同学设计的原电池装置,下列叙述中正确的是( )。

A.电极Ⅰ上发生还原反应,做原电池的正极
B.电极Ⅱ的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:选择题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:填空题
某厂的酸性工业废水中含有一定量的Na+、Al3+、 Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。

请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为_______________________________________。
(4)步骤3反应的离子方程式为_______________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是( )。
A.Na+、Ba2+、Cl-、NO3— B.Pb2+、Hg2+、S2-、SO42—
C.NH4+、H+、S2O32—、PO43— D.Ca2+、Al3+、Br-、CO32—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:选择题
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )。
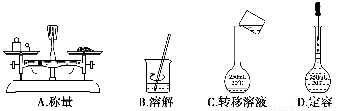
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:填空题
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下表各组归类
序号分类标准归类
AFeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2H2SO3
BCH3COOH、HOOC—COOH、HClO、H2SHF
C复分解反应、电解反应、放热反应、离子反应焰色反应
D(NH4)2SO4、NH4Cl、NH4NO3、NH3·H2ONH4HCO3
(1)A中分类标准是_____________________,H2SO3________(填“是”或“否”)可归为此类。
(2)B中分类标准是_________________________,HF________(填“是”或“否”)可归为此类。
(3)C中分类标准是__________________,焰色反应属于________变化。
(4)D中分类标准是__________________,NH4HCO3________(填“是”或“否”)可归为此类。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第14讲物质结构与性质练习卷(解析版) 题型:填空题
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是( )。
A.CaC2 B.N2H4 C.Na2S2 D.NH4NO3
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。

回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:选择题
下列转化关系在给定条件下不能实现的是( )。

A.①②③ B.②③⑤ C.③④⑤ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com