
|
对于反应3A
| |
| [ ] | |
A. |
该反应为吸热反应 |
B. |
该反应一定有能量转化成了化学能 |
C. |
反应物比生成物稳定 |
D. |
因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
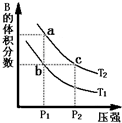 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.| 催化剂 |
| 催化剂 |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
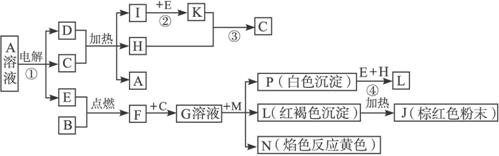
(1)写出化学式:H___________、L___________。
(2)反应①的离子方程式_____________________________________。
(3)反应②的发生,工业上采取常压操作,理由是____________________________________,对于反应③,工业上采取的操作不是使K直接与H反应,而是采用_______________________。
(4)写出反应④的化学反应方程式________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com