
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆—氧化钇为电解质,
这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b
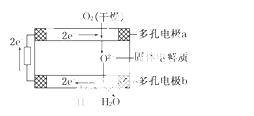 均不参与电极反应.下列判断正确的是
均不参与电极反应.下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e-===4OH-
D.b极对应的电极反应为2H2-4e-+4OH-===4H2 O
O
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是( )
①FeCl3与Cu反应 ②FeCl3与H2S反应 ③FeCl3与KI反应 ④FeCl3滴入沸水中 ⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥ B.③④⑤ C.④⑤⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分析如图 所示的四个装置,回
所示的四个装置,回 答下列问题:
答下列问题:
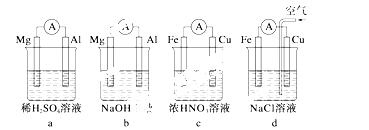
①装置a和b中铝电极上的电极反应式分别为_______________________、__________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为__________________________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为_____________________、 _______________________________________。
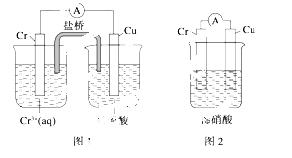
查看答案和解析>>
科目:高中化学 来源: 题型:
一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
| A | B | C | D | |
| 正极 | Cu | Al | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某蓄电池反应为NiO2+Fe+2H2O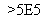 Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3 )以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。
)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。
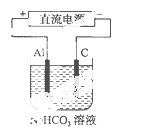
(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中
c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
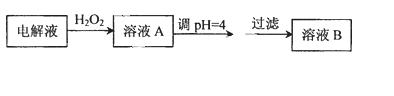
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 |
| 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气
体全部逸出,下列说法正确的是 ( )
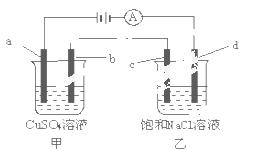
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH ——4e- = O2↑+2H2O
——4e- = O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极 增重3.2g时,d极产生的气体为2.24L(标准状况下)
增重3.2g时,d极产生的气体为2.24L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为_________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填选项字母)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液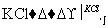 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是__________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是_________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是________(填离子符号)。
②B―→A+C反应的热化学方程式为_______________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,完全分解下列某化合物2 g,产生氧气1.6 g,此化合物是
A.1H216O B.2H216O C.1H218O D.1H218O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com