
| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 每次焰色反应实验前,铂丝要先用硫酸洗涤 | |
| B. | 用固体样品或配成相应的溶液进行焰色反应,现象相同 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | 非金属单质燃烧时火焰均为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向氢氧化镁的饱和溶液中滴加FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 等浓度的Na2CO3和Na2SO3溶液的pH,前者>后者 | 非金属性S>C |
| C | 金属镁片和铝片用灵敏电流计相连,伸入烧碱溶液中,发现镁片上有气泡 | 金属性Mg<A1 |
| D | 冰醋酸中加入水,氢离子浓度先增大,后减小 | 醋酸的电离程度先增大后减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
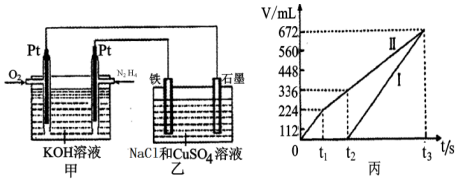
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子最外层电子数为5 | |
| B. | 当有3mol X2生成时,转移5mol电子 | |
| C. | 氧化产物和还原产物的物质的量之比为5:1 | |
| D. | “( )”括号中所填的微粒为X- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
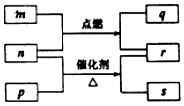 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | B. | 非金属性:Y>X>W | ||
| C. | m与q、n与s均不能共存 | D. | 若n过量,q还可以继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
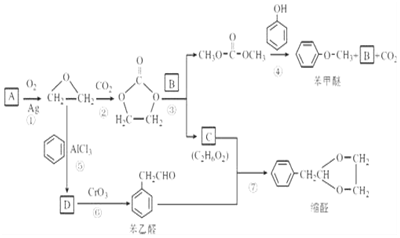
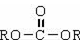 $\stackrel{2R′OH}{→}$2ROH+
$\stackrel{2R′OH}{→}$2ROH+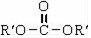
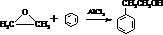 .
.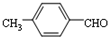 、
、 .
. 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(须注明必要的反应条件)
的合成路线(须注明必要的反应条件)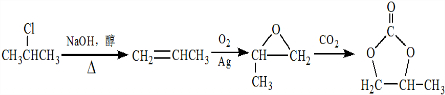 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com