


科目:高中化学 来源: 题型:
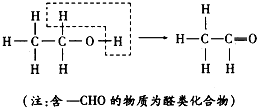
| A、(CH3)3COH |
B、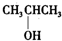 |
C、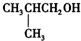 |
| D、CH3CH2CH(CH3)OH. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
| B、悬浊液中一定不含直径小于10-9m的微粒 |
| C、胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 |
| D、食盐溶液静置后会分层,下层比上层咸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
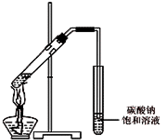
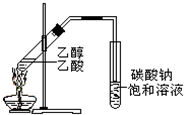 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com