
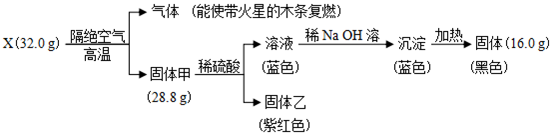
分析 流程中32gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量=32.0g-28.8g=3.2g,证明X中含氧元素,28.8g固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)=$\frac{32g}{80g/mol}$=0.4mol,结合质量守恒得到n(O2)=$\frac{3.2g}{32g/mol}$=0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.2mol:(0.4mol-0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜,据此分析回答.
解答 解:流程中32gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量=32.0g-28.8g=3.2g,证明X中含氧元素,28.8g固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)=$\frac{32g}{80g/mol}$=0.4mol,结合质量守恒得到n(O2)=$\frac{3.2g}{32g/mol}$=0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.2mol:(0.4mol-0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜,
(1)分析可知X为CuO,故答案为:CuO;
(2)固体甲为Cu2O,氧化亚铜和稀硫酸溶液发生歧化反应生成铜、二价铜离子和水,反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,
故答案为:Cu2O+2H+=Cu2++Cu+H2O;
(3)加热条件下氨气被固体X位氧化铜氧化成一种气体单质为氮气,反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
点评 本题考查了物质组成、物质性质、物质变化等,主要是化学式计算确定,反应离子方程式和化学方程式书写,掌握基础是解题关键,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:多选题
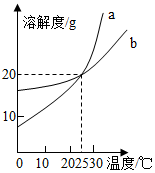
| A. | a的溶解度大于b的溶解度 | |
| B. | 在20℃时,a、b的溶液中溶质的质量分数相同 | |
| C. | b的溶解度都随温度升高而增大 | |
| D. | b都属于易溶物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
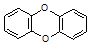 欧洲四国受“二恶英”污染的畜禽类制品、乳制品等,曾引发波及全世界的食品安全危机.我国也发出过紧急通知,禁售上述食品.“二恶英”是二苯基一,4一二氧六及其衍生物的通称.下列关于二苯基一1,4一二氧六环的叙述正确的是( )
欧洲四国受“二恶英”污染的畜禽类制品、乳制品等,曾引发波及全世界的食品安全危机.我国也发出过紧急通知,禁售上述食品.“二恶英”是二苯基一,4一二氧六及其衍生物的通称.下列关于二苯基一1,4一二氧六环的叙述正确的是( )| A. | 属于芳香烃 | B. | 相对分子质量是184 | ||
| C. | 分子式为C12H10O2 | D. | 不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA | |
| B. | 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L | |
| C. | 常温下,5.6g铁分别与足量氯气和稀硝酸反应,转移的电子数目均为0.3NA | |
| D. | 100g46%乙醇溶液中所含O-H数目为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com