
| A. | 增加CO的浓度 | B. | 加压 | C. | 分离出硫 | D. | 加催化剂 |
分析 提高脱硫率应使平衡正向进行,无法提高单位时间脱硫率的措施是应改变条件平衡逆向进行,反应是气体体积减小的放热反应,依据化学平衡的反应特征结合平衡移动原理分析选项判断,高压、降温平衡逆向进行,固体和催化剂不影响化学平衡.
解答 解:H2(g)+CO(g)+SO2(g)?H2O(g)+CO2(g)+S(s),△H<0,反应特征是气体体积减小的放热反应,提高脱硫率使平衡正向进行,
A、增加CO的浓度,可以使平衡正向进行,故A不符合;
B.高压会使平衡正向进行,故B不符合;
C、硫是固体,分离出硫对平衡无影响,故C符合;
D.加入催化剂只改变反应速率不改变化学平衡,能提高单位时间脱硫率,故D不符合;
故选:C.
点评 本题考查了化学平衡的分析应用,影响因素的分析判断,掌握化学平衡移动原理和平衡基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为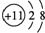 |
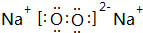 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时,失去电子越多的金属原子,其还原能力越强 | |
| B. | 目前已发现118种元素,即已发现118种原子 | |
| C. | 核外电子总数相同的粒子,必定是同种元素的原子 | |
| D. | 同一元素的各种同位素的化学性质基本相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
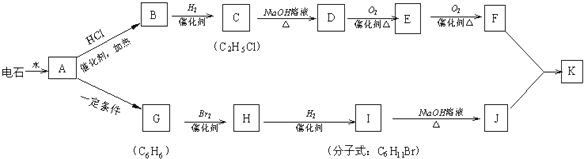
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
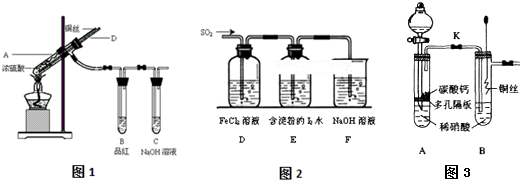
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com