
| A. | 一定温度下,反应 MgCl2(1)=Mg(1)+Cl2(g)的△H>0,△S>0 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 0.1mol•L-1CH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大 | |
| D. | 将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色逐渐褪去,说明BaCl2溶液显酸性 |
分析 A.氯化镁的分解为吸热反应,其焓变大于0;该反应为气体体积增大的反应,则熵变大于0;
B.盐酸中氢离子抑制了水的电离,氯化铵溶液中铵根离子水解,促进了水的电离;
C.稀释后醋酸的电离程度增大,而氢离子浓度减小,则溶液的pH增大;
D.氯化钡溶液呈中性,溶液之所以褪色,原因是钡离子与碳酸根离子结合生成碳酸钡沉淀,导致碳酸根离子浓度减小.
解答 解:A.Mg与氯气的反应为放热反应,则反应 MgCl2(1)=Mg(1)+Cl2(g)为吸热反应,其△H>0;该反应为混乱度增加的反应,则△S>0,故A正确;
B.常温下,pH均为5的盐酸与氯化铵溶液中,前者抑制了水的电离,而后者促进了水的电离,两溶液中水的电离程度不同,故B错误;
C.0.1mol•L-1CH3COOH溶液加水稀释,醋酸的浓度减小,则醋酸的电离程度增大,由于溶液体积增大的程度大于氢离子,则稀释后氢离子浓度减小,溶液的pH增大,故C正确;
D.加入了几滴酚酞试液的Na2CO3溶液,碳酸根离子水解显碱性,溶液为红色,而Na2CO3溶液中滴加BaCl2溶液,碳酸根离子与钡离子结合生成碳酸钡沉淀,碳酸根离子浓度减小,水解平衡逆向移动,颜色褪去,而氯化钡溶液呈中性,故D错误;
故选AC.
点评 本题考查较为综合,涉及弱电解质电离平衡、盐的水解原理、反应热与焓变、水的电离及其影响等知识,明确电离平衡及其影响为解答关键,注意掌握反应热与焓变的关系.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$ | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与硝酸制TNT | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 溴乙烷水解制乙醇 | D. | 乙烯聚合为聚乙烯高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子中所有的原子都在同一平面上 | |
| B. | 丙烯分子中三个碳原子有可能在同一条直线上 | |
| C. | 过量的丙烯通入浓溴水中,观察到溴水褪色,溶液均一稳定 | |
| D. | 丙烯既可以发生加成反应,又可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| C. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
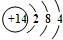 ;由①、④、⑥三种元素组成的化合物,其电子式是
;由①、④、⑥三种元素组成的化合物,其电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所有铵盐受热均可以分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液共热,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物,可用升华法分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com