
分析 高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO,反应的化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,结合反应特征和平衡移动原理分析判断选项.
解答 解:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,
a、平衡正向进行,二氧化碳减小,一氧化碳增加,CO2和CO浓度比减小,故a不符合;
b、移走少量CO,平衡正向进行,气体质量减小,体积不变,混合气体的密度减小,故b不符合;
c、移走少量CO,平衡正向进行反应物转化率增大,故c符合;
d、移走少量CO,达到新的平衡时二氧化碳减小,一氧化碳增多,所以CO的体积分数增大,故d符合;
故选:cd.
点评 本题考查了化学平衡影响因素分析判断,主要是改变物质浓度对反应平衡的理解应用,注意一氧化碳体积分数的变化分析,掌握基础是解题关键,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 硅酸钠溶液 | C. | NaOH溶液 | D. | NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
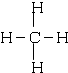 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式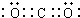 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 球棍模型 表示的有机物是乙烯 表示的有机物是乙烯 | |
| B. | 电子式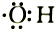 可以表示羟基,也可以表示氢氧根 可以表示羟基,也可以表示氢氧根 | |
| C. | 有机物 的分子式为C6H8O2 的分子式为C6H8O2 | |
| D. | 结构简式(CH3)2CHOH:可以表示1-丙醇,也可以表示2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com