
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________。该反应的Q______0(填“>”或“<”)。
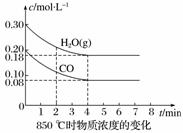
(2)850 ℃时在体积为10 L的反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的物质的量浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____________。
(3)若在500 ℃时进行。且CO、H2O(g)的起始浓度均为0.020 mol·L-1 ,该条件下,CO的最大转化率为 。
(4)若在850 ℃时进行,设起始时CO和H2O(g)共为1 mol,其中H2O(g)的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________。
答案 (1)K=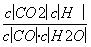 <
<
(2)0.03 mol·L-1·min-1 (3)75% (4)y=x
解析 (1)可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=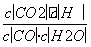 。由表中数据可知,温度越高,平衡常数越小,平衡向逆反应方向移动,因升高温度平衡向吸热方向移动,故正反应为放热反应。(2)由图像可知:CO在4 min内浓度减小了0.20 mol·L-1-0.08 mol·L-1=0.12 mol·L-1,则v(CO)=
。由表中数据可知,温度越高,平衡常数越小,平衡向逆反应方向移动,因升高温度平衡向吸热方向移动,故正反应为放热反应。(2)由图像可知:CO在4 min内浓度减小了0.20 mol·L-1-0.08 mol·L-1=0.12 mol·L-1,则v(CO)=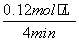 =0.03 mol·L-1·min-1。(3)500 ℃时平衡常数为9,设CO最多能转化x mol·L-1,则
=0.03 mol·L-1·min-1。(3)500 ℃时平衡常数为9,设CO最多能转化x mol·L-1,则
CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol·L-1): 0.02 0.02 0 0
转化(mol·L-1): x x x x
平衡(mol·L-1): 0.02-x 0.02-x x x
则有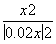 =9,解得x=0.015,则CO的最大转化率为
=9,解得x=0.015,则CO的最大转化率为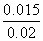 ×100%=75%。(4)850 ℃时平衡常数为1,有
×100%=75%。(4)850 ℃时平衡常数为1,有
CO(g) + H2O(g) CO2(g)+ H2(g)
起始 (mol·L-1): 1-x x 0 0
转化 (mol·L-1): y(1-x) y(1-x) y(1-x) y(1-x)
平衡 (mol·L-1): 1-x-y+xy x-y+xy y(1-x) y(1-x)
则有: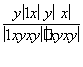 =1,解得y=x。
=1,解得y=x。


科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某浅黄色的溴水,加入CCl4震荡静置后,上层显橙红色
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为T ℃时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)2HI(g)
②2H2(g)+2I2(g)4HI(g)
下列说法正确的是( )
A.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
B.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
C.氢气在两个反应方程式中的转化率不同
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)C(g)+D(g),反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830 ℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol·L-1·s-1。下列说法中正确的是( )
A.4 s时c(B)为0.76 mol·L-1
B.830 ℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1 200 ℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素M的逐级电离能(kJ·mol-1)分别为580,1 820,2 750,11 600。该元素氧化物的化学式最可能是( )
A.MO B.MO2
C.MO3 D.M2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是__________________________________________________
__________________________________________。
(2)NH3·BF3中____________原子提供孤对电子,
____________原子提供空轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.H2O熔沸点高于H2S,HF熔沸点高于HCl
D.NaF、NaCl、NaBr、NaI的熔点依次降低
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com