
【题目】下列反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快氯酸钾的分解速率,加入二氧化锰
D.为加快过氧化氢的分解速率,把反应容器放到冷水中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计或操作能达到实验目的是
A. 除去乙烷中的乙烯气体:加入氢气在催化剂的作用下发生加成反应
B. 检验溴乙烷消去产物:反应装置经水浴加热后,将生成物直接通入酸性高锰酸钾溶液中
C. 检验柠檬醛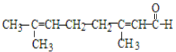 中含有碳碳双键:先加入银氨溶液充分反应后,再加入酸性高锰酸钾溶液检验
中含有碳碳双键:先加入银氨溶液充分反应后,再加入酸性高锰酸钾溶液检验
D. 除去甲苯中的少量苯酚:加入浓溴水,振荡、静置、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示,下列说法不正确的是
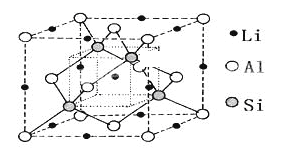
A. 晶体中Al和Si构成金刚石型骨架 B. 该化合物化学式可表示为LiAlSi
C. 晶体中与每个Al距离最近的Li为6个 D. 晶体中Al和Li构成CsCl型骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________,已知:K(300 ℃)>K(350 ℃),该反应的逆反应是_______反应(填“放热”或“吸热”)。
(2)图中表示NO2的变化的曲线是____________,用O2的浓度变化表示从0~2 s内该反应的平均速率v=_____________。
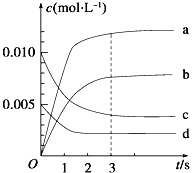
(3)能说明该反应已经达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a 及时分离出NO2气体 b 适当升高温度
c 选择高效的催化剂 d 增大O2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:
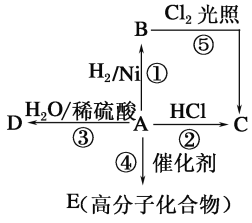
(1)写出A分子中的官能团名称:___________
(2)写出B、D的结构简式:B____________,D____________,
(3)写出②、⑤两步反应的化学方程式,并注明反应类型:
②_____________、反应类型________。
⑤______________、反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸性H2CO3>HClO>HCO3—,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO—+CO2+H2O=2HC1O+CO32—
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl—
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO—+Cl—+2H+=Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为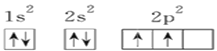
D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用周期表中同主族元素的相似性,可预测元素的性质。
(1)白磷的分子式为P4,其结构如图甲所示。科学家目前合成了N4分子,N原子的杂化轨道类型是______;N4分解后能产生N2并释放出大量能量,推测其用途为____________。
(2)N、P、As原子的第一电离能由大到小的顺序为___________。
(3)比较酸性:HNO3_______HNO2(填“强于”或“弱于”),原因是___________________
(4)立方氮化硼晶体的结构如图乙所示。该晶体中,B原子填充在N原子的______(填空间构型名称)空隙中,且占据此类空隙的比例为________(填百分数)。


(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为______;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 _______________(列出计算式,不需要计算出结果)。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com