
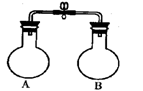
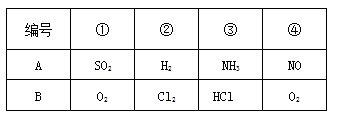
科目:高中化学 来源: 题型:阅读理解
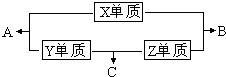 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
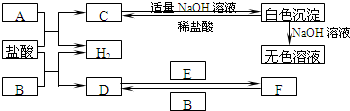
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省师大附中高二下学期期中考试化学试卷 题型:填空题
(10分)铁及铁的化合物在生产、生活中有着重 要的用途。
要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04) (3-n) / 2 ]m ,现代潜水处理工艺中常利用PFS在水体中形成絮状物 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____  ____ 。
____ 。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____ ___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____ ___。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省(天门中学等)高三上学期期中联考化学试卷(解析版) 题型:填空题
(17分)人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+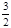 O2(g)
△H=+765.0kJ /mol。
O2(g)
△H=+765.0kJ /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。

Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)
△H=-93.0kJ /mol。
2NH3(g)
△H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
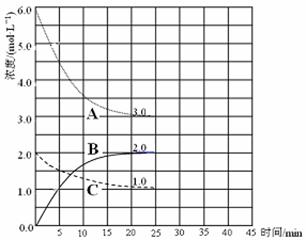
① 表示N2 的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2 的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2 浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分) (1) 2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如下图所示。
①请写出从C口通入O2发生的电极反应式___________________。
②以石墨电极电解饱和食盐水,电解开始后在______________的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为__________________(保留两位有效数字)。

(2)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2。
请用离子方程式说明上述除杂的原理___________________________________________。
(3)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为______________________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32 mol4•L-4,溶液的pH至少为____,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为 kg。(保留主要计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com