
【题目】I.字母 A~K 代表常见物质,在一定条件下能发生如图所示变化

已知:反应②中A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,反应③和反应④均在水溶液中进行。
(1)保存 J 的方法是:_____。
(2)写出反应②的化学方程式:_____。
II.某研究性学习小组的同学以 Fe(NO3)3溶液来探究 Fe3+能否氧化 Ag 为题。他们选用少量的Fe(NO3)3 溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
(1)出现少量淡淡的红棕色气体,该气体是_____。
(2)若 Fe3+能否氧化 Ag,只需证明:_____方法是:_____
Ⅲ. 铁红是一种红色颜料,其成分是 Fe2O3 ,将一定量的铁红溶于 180mL 5mol·L-1 盐酸中,在加入一定量铁粉恰好溶解,收集到 3.36L(标准状况)气体。
(1)按反应顺序写出离子方程式_____
(2)反应后的溶液中一定没有 Fe3+,理由是_____
(3)参加反应的铁粉的质量为_____g。
【答案】加入少量盐酸和铁粉 Fe2O3+2Al![]() 2Fe+Al2O3 NO2 溶液中存在Fe2+ 取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+ Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑ 氧化性:Fe3+>H+,H+参与了反应,说明Fe3+已反应完全 14
2Fe+Al2O3 NO2 溶液中存在Fe2+ 取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+ Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑ 氧化性:Fe3+>H+,H+参与了反应,说明Fe3+已反应完全 14
【解析】
Ⅰ.熔融NaCl电解生成Na和Cl2,由于D能和H2反应,则C为Na,D为Cl2;D和H2反应生成I,则I为HCl;C与H2O反应生成H溶液,则H为NaOH;D与E反应生成G,G还能和E反应生成J,而I与E反应生成H2和J,符合条件的E为Fe,则G为FeCl3,J为FeCl2;A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,高温反应生成Fe和F,符合条件的为铝热反应,则A为Fe2O3,B为Al,F为Al2O3;NaOH溶液与Al2O3反应生成NaAlO2和H2O,则K为NaAlO2;据此分析解答;
Ⅱ.(1)根据元素守恒分析可能出现的红棕色气体;
(2)Fe3+若能氧化Ag,则自身被还原为Fe2+;
Ⅲ.Fe2O3先与H+反应生成Fe3+,加入铁粉后Fe3+与Fe反应生成Fe2+,由于生成了气体,则Fe与H+反应生成H2,据此分析解答。
Ⅰ.熔融NaCl电解生成Na和Cl2,由于D能和H2反应,则C为Na,D为Cl2;D和H2反应生成I,则I为HCl;C与H2O反应生成H溶液,则H为NaOH;D与E反应生成G,G还能和E反应生成J,而I与E反应生成H2和J,符合条件的E为Fe,则G为FeCl3,J为FeCl2;A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,高温反应生成Fe和F,符合条件的为铝热反应,则A为Fe2O3,B为Al,F为Al2O3;NaOH溶液与Al2O3反应生成NaAlO2和H2O,则K为NaAlO2;
(1)J为FeCl2,Fe2+容易水解,且易被氧化,故保存方法是:加入少量盐酸和铁粉;
(2)反应②为铝热反应,化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3;
2Fe+Al2O3;
Ⅱ.(1)根据元素守恒,可能出现的红棕色气体只有NO2;
(2)Fe3+若能氧化Ag,则自身被还原为Fe2+,只需证明Fe2+的存在即可,方法是:取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+;
Ⅲ.Fe2O3先与H+反应生成Fe3+,加入铁粉后Fe3+与Fe反应生成Fe2+,由于生成了气体,则Fe与H+反应生成H2;
(1)相关的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;
(2)经过分析可知,反应后的溶液中一定没有Fe3+,理由是:氧化性:Fe
(3)氢气物质的量为![]() =0.15mol;
=0.15mol;
![]()
根据氯原子守恒,所以氯化铁的物质的量为![]() ×(0.18L×5mol/L0.3mol)=0.2mol;
×(0.18L×5mol/L0.3mol)=0.2mol;
![]()
所以参加反应的铁粉的质量为(0.15mol+0.1mol)×56g/mol=14g。


科目:高中化学 来源: 题型:
【题目】某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子。下列关于该模型的说法正确的是( )
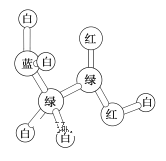
A.该模型表示一种羧酸B.该物质是一种氨基酸
C.该物质的一氯代物只有一种结构D.该物质最多有6个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
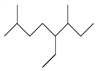
A. 如图的键线式表示烃的名称为3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式为C3H8O的醇有三种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,被酸性高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸
D. 治疗疟疾的青蒿素的结构简式为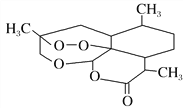 ,分子式是C15H20O5
,分子式是C15H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去):

A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝的氧化性强于锰
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,则加入的铁粉质量为
A.14gB.42gC.56gD.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式_______________
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是______________
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中,则该反应的化学方程式_______
Ⅱ. 某厂废水中含KCN,其浓度为650mgL1现用氯氧化法处理,发生如下反应(其中N均为3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是____________________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
___KOCN+___KOH+___ Cl2→_____CO2+_____N2+_____KCl+______ H2O
(3)若将10m3含KCN的浓度为650mgL1的废水中KCN氧化除去,需要标准状况下的氯气的体积为______________________L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O![]() PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质溶液的密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下所示:
FeCl3·6H2O![]() FeOOH
FeOOH![]() 纳米四氧化三铁
纳米四氧化三铁
下列有关叙述不合理的是( )
A.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
B.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径大小相等
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO===2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为2mol/LAgNO3与Cu(NO3)2溶液各0.5L混合,以铜电极进行电解,一段时间后,阴极上有1.6g铜析出。
(1)直流电源已输出__mol电子。
(2)溶液中c(Cu2+)为_mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com