
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去)。
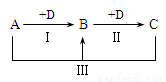
(1)若A为强碱溶液,其焰色反应显黄色,C为厨房中用品,请回答下列问题:
①D的化学式是 。
②反应III的离子方程式是 。
③现有B和C的固体混合物a g,加热至质量不再改变时剩余固体 b g,则B的质量分数为_______________。
(2)若A、D均为单质,且A为黄绿色气体,D的一种红棕色氧化物常用作颜料,则:
①反应III的离子方程式是 。
②取少许C溶液于试管中,滴入NaOH溶液并振荡,发生反应的化学方程式为:______________________________,________________________________。
③检验C溶液中金属阳离子的操作是 。
(1)①CO2;②OH-+HCO3-=H2O+CO32-;③ ;(2)①Cl2+2Fe2+=Fe3++2Cl-;②FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;③取C溶液少量于试管中,滴加少量KSCN溶液,无明显变化,再滴加少量氯水,溶液呈红色。
;(2)①Cl2+2Fe2+=Fe3++2Cl-;②FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;③取C溶液少量于试管中,滴加少量KSCN溶液,无明显变化,再滴加少量氯水,溶液呈红色。
【解析】
试题分析:(1)A为强碱溶液,其焰色反应显黄色,A为NaOH;A、B、C均含有同一种元素,C为厨房中用品,再根据转化关系得出:B为Na2CO3、C为NaHCO3、D为CO2;反应III的离子方程式是OH-+HCO3-=H2O+CO32-;2NaHCO3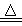 Na2CO3+CO2↑+H2O,质量减少的是CO2、H2O,根据化学反应方程式可以计算出m(NaHCO3)=
Na2CO3+CO2↑+H2O,质量减少的是CO2、H2O,根据化学反应方程式可以计算出m(NaHCO3)= g,则m(Na2CO3)=a-m(NaHCO3)=
g,则m(Na2CO3)=a-m(NaHCO3)= g,ω(Na2CO3)=
g,ω(Na2CO3)=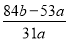 ;(2)A为黄绿色气体,D的一种红棕色氧化物常用作颜料,推出:A为Cl2,D为Fe ,根据转化关系图推知B为FeCl3、C为FeCl2,因此① 反应III的离子方程式是Cl2+2Fe2+=Fe3++2Cl-,②发生的反应FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;③验证Fe3+一般用KSCN进行检验,如果溶液变红说明有Fe3+。
;(2)A为黄绿色气体,D的一种红棕色氧化物常用作颜料,推出:A为Cl2,D为Fe ,根据转化关系图推知B为FeCl3、C为FeCl2,因此① 反应III的离子方程式是Cl2+2Fe2+=Fe3++2Cl-,②发生的反应FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;③验证Fe3+一般用KSCN进行检验,如果溶液变红说明有Fe3+。
考点:考查钠的化合物、氯气、铁化合物的性质。


科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:填空题
(16分)碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:① C (s) + H2O(g)  CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,
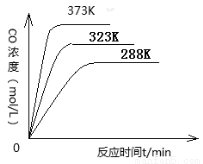
由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应: C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:填空题
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。
(1)硝酸在该反应中的作用是__________________。该反应的还原产物是________________
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:选择题
将表面已完全钝化的铝条插入下列溶液中,不发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
① 将部分粉末加入水中,振荡,有白色沉淀生成;
② 向①的悬浊液中加入过量稀盐酸,白色沉淀消失,并有气泡产生;
③ 取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
下列关于白色粉末组成的判断正确的是
A.肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2
B.肯定含有Ba(NO3)2、K2CO3,可能含有CaCl2
C.肯定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种
D.Ba(NO3)2、CaCl2、K2CO3都存在
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
下列有关金属及其合金的说法不正确的是
A.生铁和合金钢中都含碳 B.碳素钢中含碳量越高,其硬度越大韧性越好
C.青铜是我国使用最早的合金 D.目前我国流通的硬币是由合金材料制造的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第五次月考理综化学试卷(解析版) 题型:填空题
28(15分)某种碳酸锰矿的主要成分有MnCO3 、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
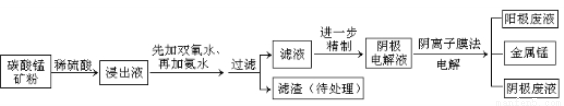
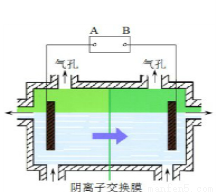
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:

加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,以石墨为电极,阳极区以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2015-2015湖南省高二12月学科联赛化学试卷(解析版) 题型:选择题
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。

下列判断正确的是
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com