
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是 ( )
A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.N2(g)+O2(g) 2NO(g) ΔH<0
2NO(g) ΔH<0
C.C(s)+2H2O(g) CO2(g)+2H2(g) ΔH>0
CO2(g)+2H2(g) ΔH>0
D.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为______________________。利用反应6NO2+8NH3  7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
2)已知:2SO2(g)+O2(g)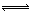 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)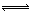 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)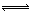 SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰6,则平衡常数K=__________________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)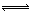 CH3OH(g)。
CH3OH(g)。
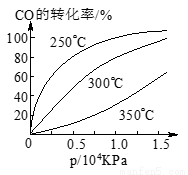
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH___________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:填空题
甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2C O2(g) △H=-566.0kJ·mol-1
O2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。

(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.应用铝热反应能焊接钢轨 B.比色法可以测定化学反应速率
C.工业制硝酸需要热交换器  D.反应热均可通过实验直接测定
D.反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:填空题
按下图所示装置进行实验,并回答下列问题:
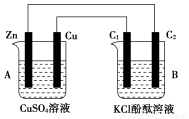
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为________极,电极反应式为________;铜极为________极,电极反应式为________;石墨棒C1为________极,电极反应式为________;石墨棒C2附近发生的实验现象为________。
(3)当C2极析出224 mL气体(标准状况下)时,锌的质量变化为:________,CuSO4溶液的质量变化为:________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
25 ℃、101 kPa 下:①2Na(s)+ O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)ΔH2=-511 kJ·mol-1下列说法正确的是 ( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH=-317 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
A.生成 2 mol SO3 B.放出热量197 kJ
C.SO2 和 SO3 共有 2 mol D.含有氧原子共有3mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3 溶液中:Al3+、NH4+、SO42-、NO3-
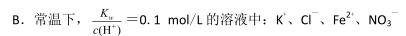
C.使甲基橙变红的溶液中:NH4+、Cl-、SO42-、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3-、S2-
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:
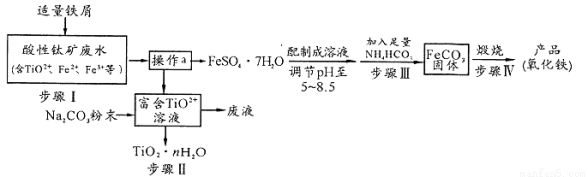
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知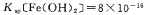 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com