
运用元素周期律分析下列推断,其中错误的是
A. 铍的最高价氧化物的水化物可能具有两性
B. 砹单质是有色固体,砹化氢很不稳定
C. 碳酸锶难溶于水,但易溶于盐酸
D. 砷的最高价氧化物的水化物是一种强酸
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
下列物质性质的比较,不正确的是
A. 稳定性:H2O>NH3
B. 碱性:NaOH >Al(OH)3
C. 氧化性:F2>C12
D. 酸性:H2SO4>HC1O4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氯气总体积(V)与时间(t)的关系正确的是( )
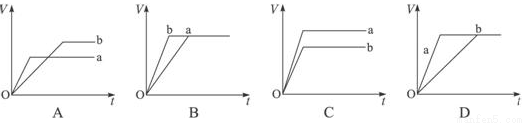
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
翡翠是由X、Y、Z、W四种短周期元素组成的矿物,可表示为XY[Z2W6],X、Y、W元素的简单离子的电子层结构相同,X的原子半径比Y的大,Z的单质是常见的半导体材料,W是地壳中含量最多的元素。下列说法不正确的是
A. Y在化合物中显+3价
B. X与W只能形成一种化合物
C. W的简单氢化物稳定性比Z的强
D. X的最高价氧化物对应的水化物碱性比Y的强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中,正确的是
A. IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VIIA族元素氢化物沸点顺序也是:HBr>HCl>HF
B. CH4是正四面体结构,则SiH4也是正四面体结构
C. 锂与氧气反应:4Li+O2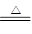 2Li2O,则钠与氧气反应:4Na+O2
2Li2O,则钠与氧气反应:4Na+O2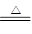 2Na2O
2Na2O
D. CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
下列对一些实验事实的解释正确的是
选项 | 实验事实 | 解释 |
A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
D | H20的沸点高于H2S | H-O键的键长比H-S键的键长短 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:简答题
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:实验题
【加试题】实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入。
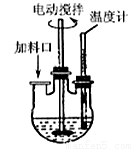
已知: I2 + Na2CO3 == NaI +NaIO +CO2↑; △H <0
3I2 + 3Na2CO3 == 5NaI +NaIO3 +3CO2↑; △H <0
I2(s) + I-(aq)  I3-(aq) ;
I3-(aq) ;
水合肼(N2H4·H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2(放热反应);100℃左右水合肼分解为氮气和氨气等。
(1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是 (填字母)。
a.将碘块研成粉末 b.起始时加少量NaI
c.将溶液适当加热 d.加大高纯水的用量
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,除防止反应速率过快,另一个原因是 。
(3)写出水合肼氧化IO-的离子方程式 。
(4)所得溶液(偏黄,且含少量SO42-,极少量的K+和Cl-)进行脱色、提纯并结晶,可制得高纯NaI晶体。实验方案为:
①、将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2CO3溶液、过滤,在滤液中加少量活性炭煮沸后 (填操作名称),这样操作的目的是 。
②、溶液在不断搅拌下加入 (填试剂名称)至溶液的PH约为6,然后 (填操作名称),再次过滤,用 洗涤晶体2~3次,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
下列叙述中正确的是(NA为阿伏加德罗常数)
A.1.7 g的羟基中含有的电子数为NA
B.标准状况下,11.2 L四氯化碳所含的原子数为2NA
C.常温常压下,18 g H2O含有的原子数为3NA
D.5.6 g金属铁变为离子时失去的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com