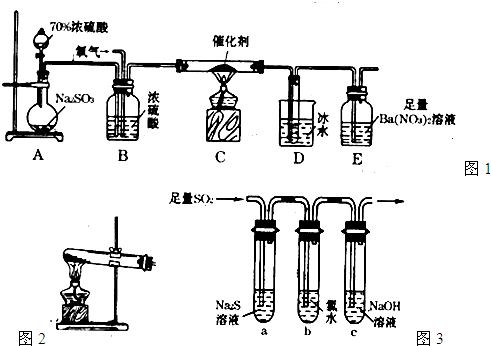
Ⅰ.如图1所示为某化学兴趣小组设计的乙醇催化氧化并验证氧化产物的实验装置(图中加热仪器,铁架台等均未画出).图中:A为无水乙醇(沸点78℃),B为绕成螺旋状的细铜丝,C为无水CuSO
4粉末,D为碱石灰,F为新制的碱性Cu(OH)
2悬浊液.

(1)在上述装置中,实验时需加热的仪器为(填代号A、B、C、D、E、F)
E、A、B、F
E、A、B、F
.
(2)为使A中乙醇平稳气化成乙醇蒸汽,常采用的方法是
水浴加热
水浴加热
.
(3)实验过程中铜网出现红色和黑色交替的现象,请写出黑色固体变为红色时,发生反应的化学方程式
CH
3CH
2OH+CuO
CH
3CHO+Cu+H
2O
CH
3CH
2OH+CuO
CH
3CHO+Cu+H
2O
.
(4)能证明乙醇反应后产物的实验现象是
F中产生红色沉淀
F中产生红色沉淀
,F处发生反应的化学方程式为
CH
3CHO+2Cu(OH)
2CH
3COOH+Cu
2O+2H
2O
CH
3CHO+2Cu(OH)
2CH
3COOH+Cu
2O+2H
2O
Ⅱ.另一课外活动小组利用图2装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管.请填写下列空白:
(1)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.乙醇的催化氧化反应是
放热
放热
反应(填“放热”或“吸热”).
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接
b、a
b、a
接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在
冰水
冰水
中.




 名校课堂系列答案
名校课堂系列答案 (1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
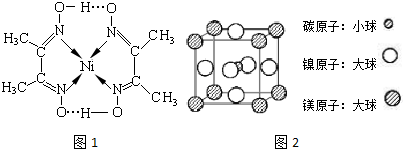
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有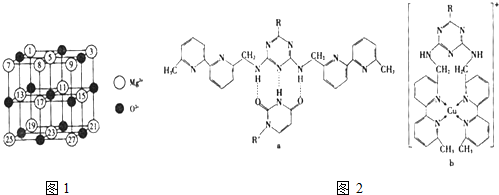
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: