
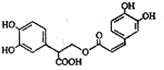
| A. | 迷迭香酸的分子式为C18H15O8 | |
| B. | 迷迭香酸可以发生加成、取代、显色反应 | |
| C. | lmol迷迭香酸跟H2反应,最多消耗6mol H2 | |
| D. | lmol迷迭香酸在NaOH溶液中反应,最多消耗5mol NaOH |
分析 该物质中含有苯环、酚羟基、羧基、酯基、碳碳双键,具有苯、酚、羧酸、酯、烯烃性质,能发生加成反应、加聚反应、氧化反应、还原反应、取代反应、水解反应等,据此分析解答.
解答 解:A.该物质分子式为C18H16O8,故A错误;
B.该物质中含有苯环、酚羟基、羧基、酯基、碳碳双键,具有苯、酚、羧酸、酯、烯烃性质,能发生加成反应、加聚反应、氧化反应、还原反应、取代反应、水解反应、显色反应等,故B正确;
C.苯环和碳碳双键能和氢气发生加成反应,所以lmol迷迭香酸跟H2反应,最多消耗7mol H2,故C错误;
D.酚羟基、酯基水解生成的羧基、羧基能和NaOH反应,所以lmol迷迭香酸在NaOH溶液中反应,最多消耗6mol NaOH,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酚、酯、烯烃等性质,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | H+,C6H5O-,CH3COO-,MnO4- | B. | 葡萄糖,Cu2+,Na+,OH- | ||
| C. | Fe3+,NO3-,SO42-,H+ | D. | OH-,Al3+,NH4+,AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
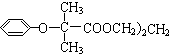
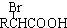 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$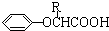
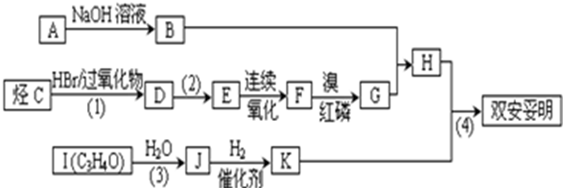
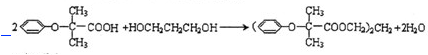
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
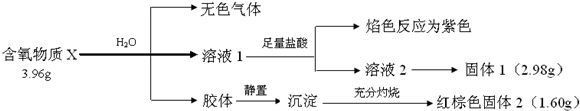
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
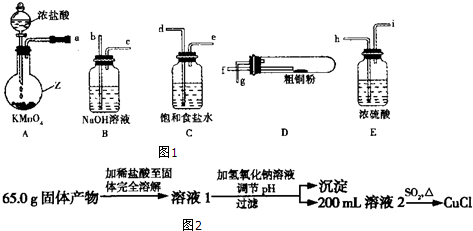
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com