
关于同一种元素的原子或离子,下列叙述正确的是( )
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子比带正电荷少的阳离子半径大
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO 、S2O
、S2O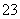
B.澄清透明溶液:Mg2+、Cu2+、Cl-、SO
C.使酚酞变红色的溶液:NH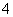 、K+、AlO
、K+、AlO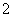 、NO
、NO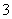
D.含0.1 mol·L-1KI的溶液:Fe3+、Na+、NO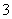 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
青霉素是一种高效广谱抗生素,经酸性水解后得到青霉素氨基酸分子,其结构简式如图。下列关于该物质的叙述不正确的是( )
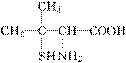
A.属于α氨基酸
B.能发生加聚反应生成多肽
C.核磁共振氢谱上共有5个峰
D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
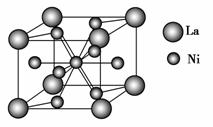
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第2周期元素
B.位于周期表第3周期ⅢA族的元素
C.原子最外电子层排布式为2s22p6的元素
D.原子最外电子层排布式为3s23p5的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)质量数为37的氯原子符号为________。
(2)S2-的结构示意图________。
(3)氮原子的电子式________,N2的电子式________,NH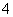 的电子式________。
的电子式________。
(4)磷原子的核外电子排布式___________________________________________,
外围电子排布式___________________________________________________,
外围电子轨道表示式______________________________________________________。
(5)按要求用三种化学用语表示基态铁原子和三价铁离子。
| Fe | Fe3+ | |
| 原子(或离子)结构示意图 | ||
| 电子排布式 | ||
| 轨道表示式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+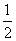 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+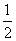 O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)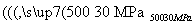 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com