
芳香族化合物A,分子式为C9H9OCl,且能发生银镜反应;D为含有八元环的芳香族化合物。A与其它物质之间的转化如下图所示:

(1)A的结构简式为 。
(2)A→E的反应条件为 ;C→D的反应类型为 。
(3)写出B→C第①步的反应方程式 。
(4)B的一种同系物F(分子式为C8H8O2)有多种同分异构体,则含有 的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
的芳香族化合物的同分异构体有 种,写出其中核磁共振氢谱有4个峰的一种结构简式 。
(5)已知: 由甲苯及其它必要物质经如下步骤也可合成B:
由甲苯及其它必要物质经如下步骤也可合成B:

反应I的试剂及条件为 :反应IV所用物质的名称为 ;
反应III的化学方程式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将0.1 mol的镁和铝的混合物溶于100 mL 2 mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示:
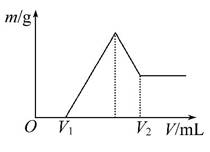
①有关反应的离子方程式为 ______________________________________。
②当V1=160 mL时,则金属粉末中n(Mg)=_________mol,V2=________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示为一个有机合成反应的流程图:

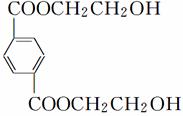
请根据图示回答下列问题:
(1)写出中间产物A、B、D的结构简式。
A______________________,B________________________________________________________________________,
D________________。
(2)在图中①至⑦的反应中属于取代反应的是________。(填序号)
(3)写出C的同分异构体X,要求符合以下两个条件:
ⅰ.苯环上有两个侧链;
ⅱ.1 mol X与足量NaHCO3溶液反应产生1 mol CO2气体。
写出符合上述两条件的X的所有结构简式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH-—→ZnO+H2O+2e-
C.正极发生氧化反应
D.电解液可以是强酸也可以是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是典型的可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO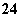
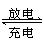
 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
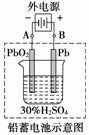
(1)放电时:正极的电极反应式是____________________________________________;
电解液中H2SO4浓度将变____;电流方向从____极流向____极。当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成______、B电极上生成________,此时铅蓄电池的正负极的极性将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种方法中,能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④ B.①③④⑤ C.①②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NOONH4(s) 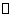 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度( | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变 H__________0(填“>”、“<”或“=”)
H__________0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是____________.(填字母)
A. 2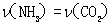
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
根据表中数据,计算25.0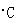 时的分解平衡常数为____________.
时的分解平衡常数为____________.
(2) 25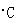 时,NH3·H2O电离常数Kb=1.8
时,NH3·H2O电离常数Kb=1.8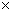 10-5,Mg(OH)2的溶度积常数Ksp=1.8
10-5,Mg(OH)2的溶度积常数Ksp=1.8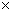 10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3
10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3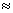 0.5)
0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图示装置进行有关实验,其中能达到实验目的或得出正确结论的是
| 选项 | ① | ② | ③ | ④ | 实验目的或结论 | 装置 |
| A | 浓盐酸 | MnO2 | 干燥红色布条 | NaOH溶液 | 干燥布条不褪色 |
|
| B | 稀硝酸 | 铜粉 | 空气 | NaOH溶液 | 制备收集NO | |
| C | 浓硫酸 | 木炭 | 品红溶液 | NaOH溶液 | 浓硫酸具有氧化性 | |
| D | 浓氨水 | NaOH固体 | 空气 | 水 | 制备收集氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com