
【题目】实验室利用下图装置用乙醇和浓硫酸反应制取乙烯,再用乙烯与溴的四氯化碳溶液反应制备1,2-二溴乙烷。
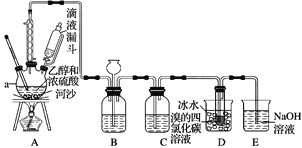
(1)在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为_______________,河沙的作用是________________。仪器a的名称为____________。
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为________。
(3)装置C可除去CO2、SO2,所盛放的溶液为________________________。
(4)装置D中进行的主要反应的化学方程式为____________;把试管置于盛有冰水的小烧杯中的目的是___________________________。
(5)装置E的作用是__________________________________。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O防止液体暴沸三颈烧瓶漏斗中的液面上升NaOH溶液CH2=CH2+Br2→BrCH2CH2Br减少溴的挥发损失吸收挥发的溴蒸气
CH2=CH2↑+H2O防止液体暴沸三颈烧瓶漏斗中的液面上升NaOH溶液CH2=CH2+Br2→BrCH2CH2Br减少溴的挥发损失吸收挥发的溴蒸气
【解析】
(1)乙醇发生消去反应生成乙烯,则生成乙烯的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O;河沙的作用类似于蒸馏装置中的沸石,作用是防止液体暴沸。根据仪器构造可知仪器a的名称为三颈烧瓶。
CH2=CH2↑+H2O;河沙的作用类似于蒸馏装置中的沸石,作用是防止液体暴沸。根据仪器构造可知仪器a的名称为三颈烧瓶。
(2)装置B可起到安全瓶的作用,若气压过大,而外压不变,则该装置中出现的现象为漏斗中的液面上升。
(3)装置C可除去CO2、SO2,二者均是酸性氧化物,因此可以用碱液除去,则所盛放的溶液为NaOH溶液。
(4)乙烯与溴发生加成反应生成1,2-二溴乙烷,所以装置D中进行的主要反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br;溴易挥发,因此把试管置于盛有冰水的小烧杯中的目的是减少溴的挥发损失。
(5)溴有毒,能溶于氢氧化钠溶液中,则装置E的作用是吸收挥发的溴蒸气,减少污染。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
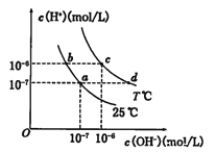
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 往碳酸镁中滴加稀盐酸:CO![]() + 2H
+ 2H![]() = CO2↑+ H2O
= CO2↑+ H2O
B. 用小苏打治疗胃酸过多:HCO![]() + H
+ H![]() = CO2↑+ H2O
= CO2↑+ H2O
C. 盐酸滴入氨水中:H![]() + OH
+ OH![]() = H2O
= H2O
D. 锌溶解于稀硝酸中:Zn+ 2H![]() =Zn2++ H2↑
=Zn2++ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C. 铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D. 碳酸钙溶于稀盐酸中:CaCO3+2H+="==" Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1的盐酸滴定20.00 mL 0.10 mol·L-1的某碱BOH溶液得到的滴定曲线如图,下列判断不正确的是
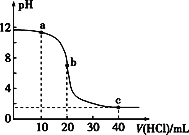
A. a点时,溶液呈碱性,溶液中c(B+)>c(Cl-)
B. b点时溶液的pH=7
C. 当c(Cl-)=c(B+)时,V(HCl)<20 mL
D. c点时溶液中c(H+)约为0.033 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com