
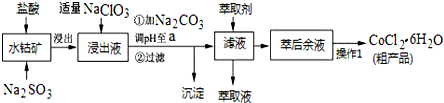
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
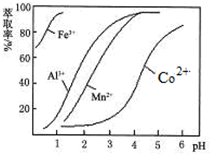
分析 含钴废料中加入盐酸,加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)根据流程图结合信息浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等进行解答;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气;
(3)根据铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳进行解答;
(4)由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀.
解答 解:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等],加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至a,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B.
点评 本题通过制取CoCl2•6H2O的工艺流程,考查了物质制备方案的设计,题目难度中等,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
| 主食 | 米饭、馒头 |
| 副食 | 烧鸡块、咸鸭蛋、红烧肉、花生米 |
| 饮料 | 牛奶 |
| 你的补充 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 的 H2SO4 溶液 pH=1 | |
| B. | 0.001 mol•L-1 的 NaOH 溶液 pH=ll | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO↑+H2O.
CO↑+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO与1.12L O2混合后的分子数小于0.1NA | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com