
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
科目:高中化学 来源: 题型:
【题目】常温下,金属离子(Mn+)浓度的负对数值随溶液pH变化关系如图所示[已知:pM=-lgc(Mn+),且假设c(Mn+)≤10-6mol/L认为该金属离子已沉淀完全]。根据判断下列说法正确的是( )
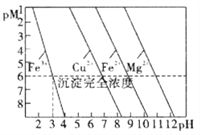
A. 常温下,Ksp[Mg(OH)2]<Ksp[Fe(OH)2]
B. 可以通过调节溶液pH的方法分步沉淀Cu2+和Fe2+
C. 除去Cu2+中少量Fe3+,可控制溶液3≤pH<4
D. pM与Ksp之间的关系式为:pM=lgKsp- nlgc(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol

(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质的变性是可逆过程
B. 天然油脂没有恒定的熔点、沸点
C. 氨基乙酸不能溶于强酸溶液中
D. 蔗糖的水解产物不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的下列化学性质中不是由羟基所决定的是
A.跟活泼金属Na等发生反应B.乙醇被酸性高锰酸钾氧化为乙酸
C.在足量O2中完全燃烧生成CO2和水D.当Cu存在时跟O2发生反应生成乙醛和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.糖类化合物也可称为碳水化合物B.油脂在碱性条件下能发生水解反应
C.医用消毒酒精中乙醇的浓度为95%D.用灼烧的方法可以区分蚕丝和人造纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质氧化镁是新型功能复合材料的重要添加剂,可由菱镁矿(含MgCO3、CaCO3、Fe2O3、Al2O3、SiO2)为原料制备,其制备流程如下:

(1)酸溶时,为了提高酸溶速率可采用的措施有______;提高矿物的浸取率可采取的措施有______。(各答一条即可)
(2)浓硫酸与Al2O3反应的化学方程式为___________;滤渣I的主要成分为______和______(填化学式)。
(3)用氨水调节溶液pH =8~9的目的是______,若氨水加的量较多使pH >9,则最终氧化镁的产量会______(填“增大”“不变”或“减小”)。
(4)沉镁时发生反应的离子方程式为________________。
(5)流程中“焙烧”操作若在实验室中进行,样品应放在______中加热(填仪器名称),当______时,说明固体样品已分解完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=Q 中Q等于( )
O2(g)===CO(g) ΔH=Q 中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com