
| A.50.8 g | B.66.4 g | C.44.8g | D.39.2g |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.(NH4)2SO4 | B.NH4NO3 | C.NH4Cl | D.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
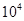 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。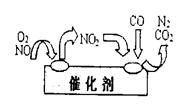
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

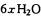 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
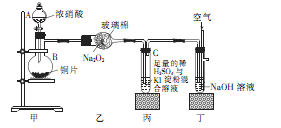

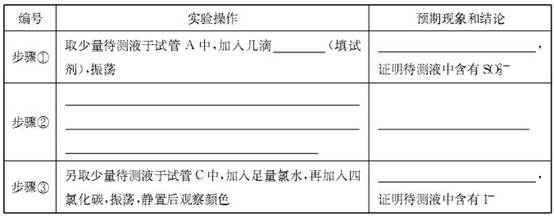
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
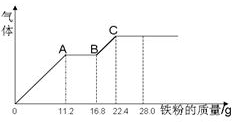
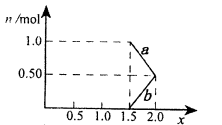
| A.原混合液中NO3-的物质的量为0.4mol |
| B.c(H2SO4)为5mol·L-1 |
| C.溶液中最终溶质为FeSO4 |
| D.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
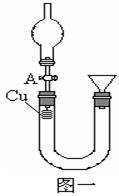
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com