
| A. | ${\;}_{53}^{135}$I位于元素周期表中第4周期ⅦA族 | |
| B. | ⅦA族氢化物的沸点:HF<HCl<HBr<HI | |
| C. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 | |
| D. | ${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的两种同位素 |
分析 A.I的原子序数为53,原子结构中有5个电子层、最外层电子数为7;
B.HF分子间含氢键,沸点最高;相对分子质量大的沸点高;
C.质子数=核外电子数=53,中子数为135-53=82;
D.同位素的分析对象为原子.
解答 解:A.I的原子序数为53,原子结构中有5个电子层、最外层电子数为7,则位于周期表中第5周期ⅦA族,故A错误;
B.HF分子间含氢键,沸点最高;相对分子质量大的沸点高,则沸点为HCl<HBr<HI<HF,故B错误;
C.质子数=核外电子数=53,中子数为135-53=82,则中子数与核外电子数之差为82-53=29,故C正确;
D.同位素的分析对象为原子,则${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的单质,故D错误;
故选C.
点评 本题考查元素周期表结构及应用,为高频考点,把握元素周期表的结构、元素的位置、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

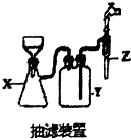
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 临氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: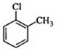 CH2Cl-CH2Cl CH2Cl-CH2Cl 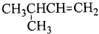 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现五组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
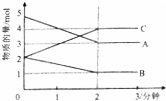 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)  | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com