
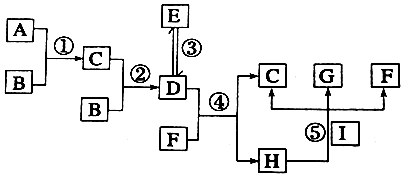
分析 已知:①A、B、I为常见的单质,其余为化合物;
②化合物C、D、E由相同元素组成,且相对分子质量关系有:M(E)=2M(D),M(D)=M(C)+16;
③G的稀溶液显蓝色为铜离子的溶液,I单质为Cu,则H为稀硝酸,上述分析可知D为NO2,E为N2O4,C为NO,F为H2O,G为Cu(NO3)2,
转化关系中A、B、I为常见的单质,其余为化合物,则B为O2,A为N2,综上所述可知:
A为N2,B为O2,C为NO,D为NO2,E为N2O4,F为H2O,G为Cu(NO3)2,H为HNO3,I为Cu,据此分析.
解答 解:已知:①A、B、I为常见的单质,其余为化合物;
②化合物C、D、E由相同元素组成,且相对分子质量关系有:M(E)=2M(D),M(D)=M(C)+16;
③G的稀溶液显蓝色为铜离子的溶液,I单质为Cu,则H为稀硝酸,上述分析可知D为NO2,E为N2O4,C为NO,F为H2O,G为Cu(NO3)2,
转化关系中A、B、I为常见的单质,其余为化合物,则B为O2,A为N2,综上所述可知:
A为N2,B为O2,C为NO,D为NO2,E为N2O4,F为H2O,G为Cu(NO3)2,H为HNO3,I为Cu,
(1)E的分子式为:N2O4,
故答案为:N2O4;
(2)反应①是氮气和氧气放电反应生成一氧化氮,反应的化学方程式:N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO;
(3)反应⑤是铜稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(4)单质I为Cu与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:能;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(5)若保持反应体系的温度和体积不变,反应③为N2O4?2NO2,平衡体系中加入一定量的D为NO2,相当于增大压强,平衡逆向进行,则达到平衡时,D的转化率增大,
故答案为:增大;
(6)假设C和D的物质的量之比恰好为1:1,则两者的混合物相当于一种酸酐(+3价的氧化物)N2O3.用烧碱溶液吸收物质的量之比为1:1的C、D混合物反应生成亚硝酸钠,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,
故答案为:NO+NO2+2NaOH=2NaNO2+H2O.
点评 本题考查了物质转化关系的分析、物质性质、特征反应条件等,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
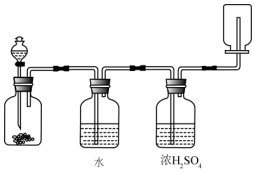
| A. | 锌和盐酸生成氢气 | B. | 氯酸钾和二氧化锰生成氧气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3在水溶液中的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | NaHCO3溶液与NaOH溶液反应的离子方程式为H++OH-=H2O | |
| C. | NH4NO3溶液与NaOH稀溶液反应的离子方程式为NH4++OH-=NH3•H2O | |
| D. | NH4NO3溶液与足量Ba(OH)2溶液反应的离子方程式为Ba2++CO32-=BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
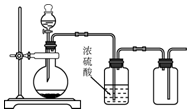
| A. | 用锌和稀硫酸制备H2 | B. | 用铜和稀硝酸制备NO | ||
| C. | 用30%H2O2水溶液和MnO2制备O2 | D. | 用MnO2和浓盐酸制备Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定为1:1 | B. | 可能为2:3 | C. | 一定为3:2 | D. | 可能为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 纯净的H2在Cl2中燃烧 | 安静地燃烧,并发出苍白色火焰 | 说明燃烧不一定需要氧气参加 |
| B | 分别将蘸有浓氨水和浓硫酸的玻璃棒靠近 | 产生白烟 | NH3能和酸反应生成了相应的铵盐 |
| C | 把SO2通入高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 说明SO2只具有漂白性 |
| D | 高温下,SiO2与纯碱混合加热,产生气体通入澄清石灰水 | 石灰水变浑浊 | 说明硅酸的酸性比碳酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com