
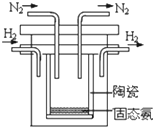
 (1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 催化剂 |
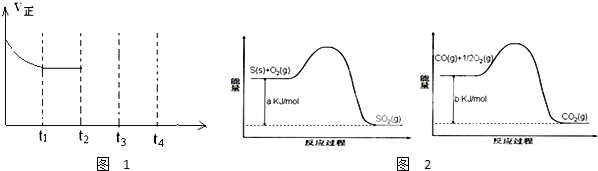
| 180℃ |
| 催化剂 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg?L-1) | ≤23 000 | ≤150 |
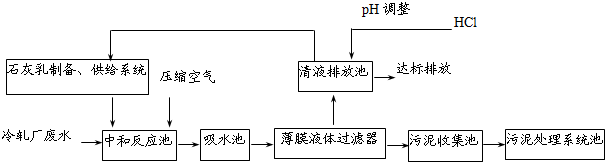
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液体分层,上层为四氯化碳层,黄色 |
| B、液体分层,上层为水层,紫色 |
| C、液体分层,下层为四氯化碳层,紫色 |
| D、液体分层,下层为水层,黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
| B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
| C、用瓷坩埚加热熔化碳酸钠固体 |
| D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| A、①② | B、②④ | C、③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 若反应为2A(g)+B(g)?2C(g),则△H>0,P2>P1 |
B、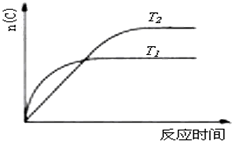 若反应为2A(g)?C(g),则△H>0,T1>T2 |
C、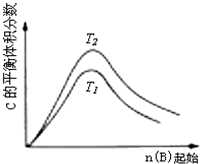 反应为3A(g)+B(g)?2C(g),则△H>0,T2>T1;或△H<0,T2<T1 |
D、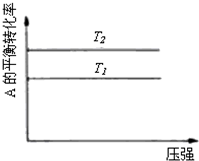 反应为A(g)+B(g)?2C(g),则△H<0,T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com