
已知298K下反应2Al2O3(s)+3C(s)==4Al(s)+3CO2(g) ΔH=+2171kJ·mol-1
△S=+635.5J·mol-1·K-1,则此反应
| A.高温下可自发进行 | B.任何条件下都可自发进行 |
| C.任何条件下都不可自发进行 | D.低温下可自发进行 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
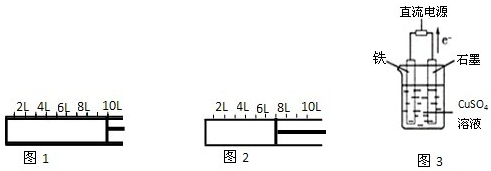
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
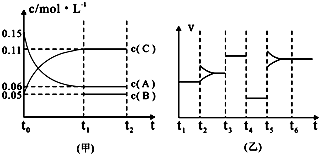
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时反应2SO2( g ) + O2( g ) ![]() 2SO3( g );△H = -197 kJ · mol-1 ,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
2SO3( g );△H = -197 kJ · mol-1 ,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
A.2a2 <a1< 197
B.2a2 >a1 >197
C.2a2 = a1 >197
D.2a2 = a1 = 197
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com