
 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.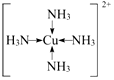 (用元素符号表示).
(用元素符号表示).分析 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期,B元素原子含有3个能级,且每个能级所含的电子数相同,则B的核外电子排布式为1s22s22p2,则B为C,D的原子核外有8种运动状态不同的电子,则D为O,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子,则E的价电子排布式为3d64s2,则E为Fe,F与E处于同周期,原子序数比E大3,则F为Cu,B为C,D为O,所以C为N,元素处于前四周期,则A为H,据此分析解答.
解答 解:A为H,B为C,C为N,D为O,E为Fe,F为Cu,
(1)基态C原子的价层电子排布式为:2s22p3,则其价电子排布图为: ,
,
F为Cu,基态外围电子排布式为:3d104s1,
故答案为: ;3d104s1;
;3d104s1;
(2)A.SiO2是原子晶体,CO2是分子晶体,原子晶体熔沸点大于分子晶体,则沸点:SiO2>CO2,A项解释不对,故A错误;
B.B为C,C为N,D为O,第一电离能第VA族元素大于相邻主族元素,所以第一电离能N>O>C,即B<D<C,故B错误;
C.N2与CO原子数目相同,价电子数目相同,二者为等电子体,结构相似,故C正确;
D.稳定性:H2O>H2S,是因为非金属性O>S,与分子之间存在氢键无关,故D错误,
故选C;
(3)F为Cu,位于周期表中ds区,C与A形成的气体为NH3,向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,形成的是配离子,为[Cu(NH3)4]2+,NH3与Cu2+之间形成的是配位键,则该离子的结构式为: ,
,
故答案为: ;
;
(4)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2、sp3;
(5)由B单质的一种同素异形体的晶胞结构可知,B原子有4个位于晶胞内部,其余B原子位于定点、面心,则一个晶胞中所含B原子数为4+$8×\frac{1}{8}+6×\frac{1}{2}$=8,
故答案为:8;
(6)O与Cu形成离子个数比为1:1的化合物为CuO,晶胞与NaCl类似,其晶胞结构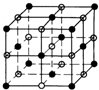 ,晶胞中铜离子数目=阳离子数目=$8×\frac{1}{8}+6×\frac{1}{2}$=4,O2-离子的半径为a pm,Cu2+离子的半径b pm,则晶胞中原子总体积=4×$(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})p{m}^{3}$,晶胞棱长=2(a+b)pm,故晶胞体积=8(a+b)3pm3,故该晶胞的空间利用率=$\frac{4×(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})}{8(a+b)^{3}}×100%$=$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}×100%$,
,晶胞中铜离子数目=阳离子数目=$8×\frac{1}{8}+6×\frac{1}{2}$=4,O2-离子的半径为a pm,Cu2+离子的半径b pm,则晶胞中原子总体积=4×$(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})p{m}^{3}$,晶胞棱长=2(a+b)pm,故晶胞体积=8(a+b)3pm3,故该晶胞的空间利用率=$\frac{4×(\frac{4}{3}π{a}^{3}+\frac{4}{3}π{b}^{3})}{8(a+b)^{3}}×100%$=$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}×100%$,
故答案为:$\frac{2π({a}^{3}+{b}^{3})}{3(a+b)^{3}}×100%$.
点评 本题主要考查物质的结构与性质,涉及核外电子排布、电负性、等电子体、晶体类型与性质、配合物、杂化理论、晶胞计算等,难点是晶胞的计算,明确各个字母的含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指单位时间内任何一种反应物物质的量的浓度的减少或任何一种生成物的物质的量的浓度的增加 | |
| B. | 化学反应速率为1.0 mol•L-1•s-1,是指在1 s时某物质的浓度是1.0 mol•L-1 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象不一定越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中沉淀一定比乙多 | B. | 甲和乙中沉淀可能一样多 | ||
| C. | 甲中沉淀可能比乙多 | D. | 乙中沉淀一定比甲多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )
有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )| 容器 | 起始时 | ||
| T/℃ | n(HCl)/mol | Z | |
| Ⅰ | 300℃ | 0.25 | a |
| Ⅱ | 300℃ | 0.25 | b |
| Ⅲ | 300℃ | 0.25 | 4 |
| A. | △H<0,a<4<b | |
| B. | 容器III某时刻处R点,则R点的v(正)<v(逆),压强:P(R)>P(Q) | |
| C. | 300℃该反应的平衡常数的值为640 | |
| D. | 若起始时,在容器Ⅳ中只充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中 HCl的物质的 量浓度大于0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )
常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )| A. | 由图中信息可知HA为弱酸 | |
| B. | 在N点pH=7,酸碱恰好完全反应 | |
| C. | 常温时一定浓度的MA稀溶液显中性 | |
| D. | K 点对应的溶液中,c(M+)+c(MOH)=2c (A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 解释 |
| A | 量取浓硫酸后,慢慢转入容量瓶中 | 浓硫酸溶于水放出大量的热,在容量瓶中溶解更安全 |
| B | 配制氢氧化钠时,应为容量瓶选择合适的塑料瓶塞 | 氢氧化钠溶液与玻璃塞中的二氧化硅反应 |
| C | 定容时,改用胶头滴管滴加蒸馏水 | 容易控制滴加的水量,减小误差 |
| D | 定容时,发现液面高度超过刻度线后,立即用干净胶头滴管吸去多余液体 | 由于及时吸去多余水量,浓度不会受影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 常温下用0.100 0mol•L-1的盐酸分别逐滴加入到20.00mL 0.100 0mol•L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示.下列说法正确的是( )
常温下用0.100 0mol•L-1的盐酸分别逐滴加入到20.00mL 0.100 0mol•L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示.下列说法正确的是( )| A. | 分别加入盐酸10 mL时:c(X+)>c(M+)>c(Y+)>c(Cl-) | |
| B. | 分别加入盐酸15 mL时:c(Cl-)>c(X+)>c(MOH)>c(YOH) | |
| C. | 分别加入盐酸至pH=7时:c(X+)=c(M+)=c(Y+) | |
| D. | 将分别加入盐酸20 mL后的三种溶液混合:c(H+)+c(Y+)=c(OH-)+c(X+)+c(MOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com