
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是__________,C中含氧官能团的名称为__________。
(2)F的结构简式为______,A和E生成F的反应类型为______。
(3)A生成B的化学方程式为_______________。
(4) B与乙炔钠合成C的反应类型(酸化前)是_________;写出由C合成D的第二个反应的化学方程式_____________。
(5)同时满足下列条件的E的同分异构体有__________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
【答案】环己醇 羟基  酯化(取代)反应
酯化(取代)反应  加成反应
加成反应  9
9
【解析】
![]() 与酸反应得到E为
与酸反应得到E为![]() ;结合A的分子式可知苯酚与氢气发生加成反应,故A为环己醇
;结合A的分子式可知苯酚与氢气发生加成反应,故A为环己醇![]() ,E与A发生酯化反应生成F为酯
,E与A发生酯化反应生成F为酯![]() ;环己醇发生催化氧化生成B为环己酮:
;环己醇发生催化氧化生成B为环己酮:![]() ;对比B、C的结构,可知H-C≡CNa与环己酮先发生加成反应引入羟基,然后酸化氢离子替代钠离子。对比C、D结构,可知第一步是C中酚羟基中H原子被—COCl替代,第二步是氯原子被氨基替代,据此分析解答。
;对比B、C的结构,可知H-C≡CNa与环己酮先发生加成反应引入羟基,然后酸化氢离子替代钠离子。对比C、D结构,可知第一步是C中酚羟基中H原子被—COCl替代,第二步是氯原子被氨基替代,据此分析解答。
根据上述分析可知A为![]() ;B为
;B为![]() ;C为
;C为![]() ;D为
;D为![]() ;E为
;E为![]() ;F为
;F为![]() 。
。
(1)A为![]() ,化学名称是环己醇;C结构简式为
,化学名称是环己醇;C结构简式为![]() ,C中含氧官能团的名称为羟基;
,C中含氧官能团的名称为羟基;
(2)由分析可知,F的结构简式为:![]() ,A中含有醇羟基,E中含有羧基,二者在酸作催化剂时,在加热条件下发生酯化反应产生F
,A中含有醇羟基,E中含有羧基,二者在酸作催化剂时,在加热条件下发生酯化反应产生F![]() 和水,该反应酯化反应,也属于取代反应;
和水,该反应酯化反应,也属于取代反应;
(3)A是环己醇,由于羟基连接的C原子上含有H原子,所以在Cu作催化剂时,被氧化产生环己酮![]() ,则A生成B的化学方程式为:
,则A生成B的化学方程式为: ;
;
(4)对比B、C的结构,可知H—C≡CNa与环己酮首先发生加成反应引入羟基,然后再酸化H+替代Na+。所以B与乙炔钠在酸化前合成C的反应类型是加成反应;对比C、D结构,可知第一步是C中酚—OH中H原子被—COCl替代,第二步是Cl原子被氨基—NH2替代,则由C合成D的第二反应的化学方程式: ;
;
(5)同时满足下列条件的E(![]() )的同分异构体:①遇FeCl3溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,说明含有醛基或甲酸形成的酯基,若含有2个取代基为:—OH、—OOCH,二者在苯环上的位置有邻、间、对3种;若含有3个取代基为:2个—OH、1个—CHO,而2个—OH有邻、间、对3种位置,对应的—CHO分别有2种、3种、1种位置,故符合条件的同分异构体共有3+2+3+1=9种。
)的同分异构体:①遇FeCl3溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,说明含有醛基或甲酸形成的酯基,若含有2个取代基为:—OH、—OOCH,二者在苯环上的位置有邻、间、对3种;若含有3个取代基为:2个—OH、1个—CHO,而2个—OH有邻、间、对3种位置,对应的—CHO分别有2种、3种、1种位置,故符合条件的同分异构体共有3+2+3+1=9种。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g) ![]() CO(g)+H2(g)+CH4 (g) △H1
CO(g)+H2(g)+CH4 (g) △H1
CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应I的△H=____(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当n(O2)/n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。
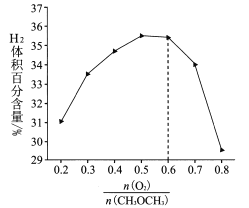
A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C .n(O2)/n(CH3OCH3)>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
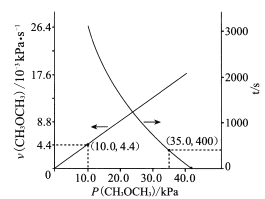
①t=400 s时,CH3OCH3的转化率为____(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_____s-1;400 s时v(CH3OCH3)=_____kPa.s-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是____,其理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电AGDIB 电池(铝一石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1Al。放电过程如图,下列说法正确的是( )

A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 充电时B 电极反应式为Cx+PF6--e-=CxPF6
D. 废旧AGDIB 电池“放电处理”时,若转移lmol 电子,石墨电极上可减轻7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
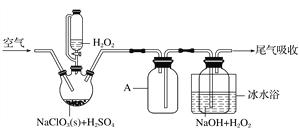
图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。
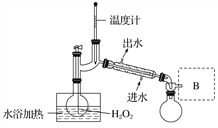
图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lg[ ]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是
]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是

A. 该滴定过程可选择酚酞作为指示剂
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )

A. 水电离出的H+浓度:a<b<c<d
B. 氢氟酸的电离平衡常数:Ka=![]()
C. V=20
D. b点溶液中:c(F-)>c(HF)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com