
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
分析 A.反应是吸热还是放热与反应条件无关;
B.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律;
C.氯化铵与氢氧化钡晶体混合就能发生;
D.反应是吸热还是放热与是否加热无关.
解答 解:A.反应是吸热还是放热与反应条件无关,所有的燃烧均为放热反应,需要加热引燃,故A错误;
B.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律,化学反应中的能量变化通常表现为热量的变化.所以化学反应除了生成新的物质外,还伴随着能量的变化,能量变化通常表现为热量的变化,即放热和吸热,故B正确;
C.氯化铵与氢氧化钡晶体混合就能发生,但是为吸热反应,故C错误;
D.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故D错误;故选B.
点评 关于解答化学中吸热或放热的类型题时,应该熟练记住吸热或放热的判断规律,可以起到事半功倍的目的.


科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
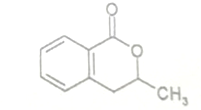
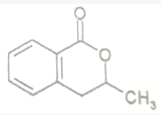 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$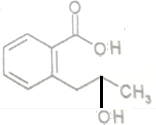 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
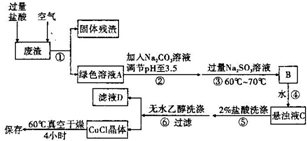 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com