
【题目】游泳池的水变绿主要是因为细菌及藻类的急剧繁殖导致的。
(1)含氯物质可以作为游泳池的消毒剂。一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5 mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖。
①夏季,露天游泳池水由于连续下雨会导致藻类大量繁殖,其原因是_____________________。
②消毒剂的错误使用也会导致藻类大量繁殖,游泳池水变绿。若水中的余氯以次氯酸形式存在,再加入H2O2进行消毒也会导致池水变绿,写出次氯酸与H2O2发生反应生成盐酸的化学方程式____________________。
(2)处理池水变绿的方法分为五步。
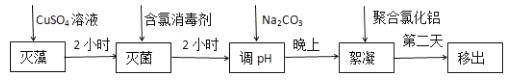
①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡,加入CuSO4溶液后需要打开水循环系统,其作用是__________________________。
②含氯消毒剂杀菌消毒主要体现出的化学性质是_________________。
③选用Na2CO3调节pH至7.5,用化学用语和文字解释其原因________________。
④ 聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出。稀释聚合氯化铝会产生胶体,其离子反应方程式是_____________________________;当温度大于80℃时,水体中铝离子的总浓度会降低,其原因是_____________________。
【答案】雨水降低了余氯的浓度,同时正常雨水为酸性,会降低溶液的pH,这样会导致细菌和水藻大量繁殖H2O2 +HClO=HCl+ O2↑+H2O混合均匀氧化性CO32-可以消耗溶液中的氢离子,产生的CO2 可以直接排出体系,同时碳酸钠溶液
显碱性:CO32-+ H2O![]() HCO3-+ OH- ,可以起到调节溶液至弱碱性的目的Al3++ 3H2O Al(OH)3+3H+温度升高,Al3++ 3H2O
HCO3-+ OH- ,可以起到调节溶液至弱碱性的目的Al3++ 3H2O Al(OH)3+3H+温度升高,Al3++ 3H2O![]() Al(OH)3(胶体)+3H+ 平衡正向移动,生成Al(OH)3沉淀
Al(OH)3(胶体)+3H+ 平衡正向移动,生成Al(OH)3沉淀
【解析】
(1)①含氯物质可以作为游泳池的消毒剂.一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖,露天游泳池水由于连续下雨和高温(28~30℃),雨水降低了余氯的浓度,同时正常雨水为酸性,会降低溶液的pH,这样会导致细菌和水藻大量繁殖;②次氯酸与过氧化氢反应生成氧气、氯化氢和水,反应的化学方程式为:H2O2+HClO=HCl+O2↑+H2O;
(2)①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡;CuSO4溶液也能够杀菌,其原理是:加入CuSO4溶液后需要打开水循环系统,其作用是重金属使蛋白质变性;混合均匀;
②含氯消毒剂杀菌消毒主要体现出的化学性质是强氧化性,杀菌消毒;
③选用Na2CO3调节pH至7.5,溶解后溶液中的CO32-可以消耗溶液中的氢离子,产生的CO2可以直接排出体系,同时碳酸钠溶液显碱性:CO32-+H2OHCO3-+OH-,可以起到调节溶液至弱碱性的目的;
④聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出.稀释聚合氯化铝,铝离子水解会产生胶体,其离子反应方程式是:Al3++ 3H2O Al(OH)3(胶体)+3H+,温度大于80℃时,水体中铝离子的总浓度会降低,其原因是温度升高,Al3++3H2OAl(OH)3(胶体)+3H+平衡正向移动,生成Al(OH)3沉淀。


科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是

A. 与金属钠反应时,键①断裂
B. 在加热和Cu催化下与O2反应时,键①、③断裂
C. 与浓硫酸共热发生消去反应时,键②③断裂
D. 与乙酸、浓硫酸共热发生酯化反应时,键①断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况,忽略N2O4),则反应中消耗HNO3的物质的量为
A. 1molB. 0.05molC. 1.05molD. 0.11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃ 时, 0.05mol/LH2SO4溶液的PH=_________;
(2)0.05mol/LBa(OH)2溶液在100℃ 时的PH=_______;
(3)常温下,将0.1mol/L盐酸和0.06mol/LBa(OH)2溶液等体积混合,混合溶液的pH是______;
(4)常温下,将pH=10 NaOH溶液和PH=13 Ba(OH)2溶液等体积混合,混合溶液的pH约为________;
(5)在某温度下,Ca(OH)2饱和溶液的浓度为0.02 mol·L-1,则KSP{ Ca(OH)2}为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴,设计了如下流程:
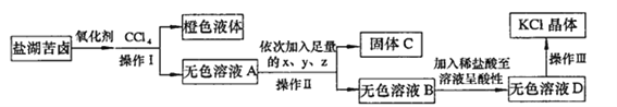
回答以下问题:
(1)操作I的名称是__________________。从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯、温度计、锥形瓶外,还需要
_________________________。
(2)试剂z的化学式为_____________;检验SO42-已除尽的方法是_____________________________。
(3)无色溶液B中加入稀盐酸至溶液呈酸性,发生反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等,W元素的主族序数和周期数相同。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”“铁强化酱油”“高钙牛奶”“含氟牙膏”等商品。这里的碘、铁、钙、氟应理解为
A.元素B.单质C.分子D.氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com