
| A. | 1种 | B. | 3种 | C. | 2种 | D. | 4种 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
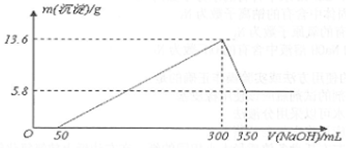
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | |
| 二 | a | b | c | ||||
| 三 | d | e | f | g | h | i |
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的正极 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 该电池放电过程中电解质溶液浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的物质的量甲<乙 | ||
| C. | 平均反应速度:乙>甲 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中各组分的浓度发生改变 | B. | 平衡体系中气体密度发生改变 | ||
| C. | 正、逆反应速率不相等了 | D. | 平衡体系中气体压强发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com