
①同温、同压下,质量相等的SO2和CO2相比较,体积之比为 ,
已知SO2和CO2均为酸性氧化物,写出CO2与足量NaOH溶液反应的离子方程式 ;
②某溶液中可能含有大量下列阴离子:OH﹣、SO42﹣、CO32﹣、Cl﹣.
(1)当溶液中存在大量H+时,则溶液中不可能有 .
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有 ,用离子方程式写出不可能存在的原因 、 .
考点: 离子共存问题;离子方程式的书写;物质的量的相关计算.
分析: ①根据V=nVm= Vm可知,等质量的气体在相同条件下体积之比与摩尔质量成反比;
Vm可知,等质量的气体在相同条件下体积之比与摩尔质量成反比;
氢氧化钠足量,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;
②(1)溶液中存在大量氢离子,与氢离子反应的离子不能大量共存;
(2)溶液中存在大量钡离子,则与钡离子反应的离子不能共存;钡离子与硫酸根离子、碳酸根离子反应生成硫酸钡、碳酸钡沉淀.
解答: 解:①同温、同压下,根据V=nVm= Vm可知,质量相等的SO2和CO2相比较,体积之比与其摩尔质量成反比,所以二者的体积之比为:44g/mol:64g/mol=11:16;
Vm可知,质量相等的SO2和CO2相比较,体积之比与其摩尔质量成反比,所以二者的体积之比为:44g/mol:64g/mol=11:16;
CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH﹣=CO32﹣+H2O,
故答案为:11:16;CO2+2OH﹣=CO32﹣+H2O;
②当溶液中存在大量H+时,OH﹣、CO32﹣与H+反应,在溶液中不能共存;
当溶液中有大量的Ba2+存在时,Ba2+与SO42﹣、CO32﹣发生反应:Ba2++SO42﹣=BaSO4、Ba2++CO32﹣=BaCO3,在溶液中不能大量共存,
故答案为:OH﹣、CO32﹣;Ba2++SO42﹣=BaSO4;Ba2++CO32﹣=BaCO3.
点评: 本题考查了离子共存、离子方程式书写、有关物质的量的计算,题目难度中等,注意掌握离子反应发生条件,明确离子共存的判断方法及离子方程式的书写原则,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl﹣,则SO42﹣为()
A. 0.1 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)═N2O4(g) (无色),如图所示.
(1)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18mol/(L•min),乙中v(N2O4)=0.2mol/(L•s),则乙中反应更快.
(2)在0到1min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率60%,反应开始时与反应达平衡状态时的压强之比为 .
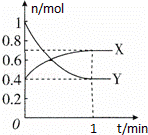
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式不正确的是()
A. 用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O
B. Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑
C. 澄清石灰水跟稀盐酸:H++OH﹣=H2O
D. 碳酸氢钠溶液跟氢氧化钠溶液反应HCO3﹣+OH﹣=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
3Cl2+8NH3=6NH4Cl+N2的反应中,被氧化的NH3与未被氧化的NH3的分子数之比为()
A. 1:6 B. 3:1 C. 1:3 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,彼此化学性质一定相似的是( )
|
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
|
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
|
| C. | 2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 |
|
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
国际通用的元素符号是用1个或2个拉丁文字母表示的,其中第一个字母大写,第二个字母小写.镍元素的拉丁文名称为Niccolum,则镍的元素符号为( )
|
| A. | Ni | B. | NI | C. | N | D. | Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
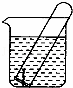
如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣.
(2)若试管内液面上升,发生 腐蚀,电极反应:负极: ,正极:
(3)若试管内液面下降,则原溶液呈酸性,发生的电极反应:负极: ,正极: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com