
| A. | 发生氧化反应 | B. | 与电源正极相连 | C. | 是铂电极 | D. | 得电子 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
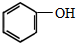 (制酚醛树脂)
(制酚醛树脂) 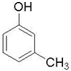 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
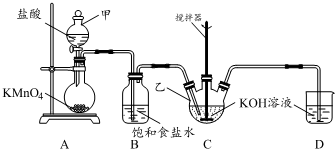 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
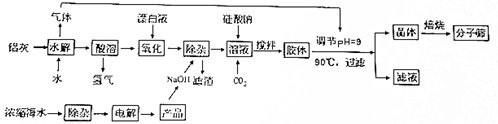
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
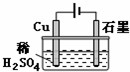
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主反应方程式为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度几乎不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
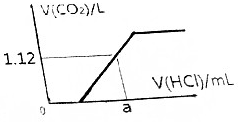 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com