
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
分析 A.庚烷标况下不是气态;
B.碳正离子(CH5+)所含的电子总数为6+5-1=10;
C.56g铁粉即1mol铁粉在1mol氯气中燃烧,铁粉过量;
D.丙烷分子中含C-H键8个.
解答 解:A.标况下庚烷不是气体,不能使用标况下的气体摩尔体积计算1L庚烷的物质的量,故A错误;
B.1mol碳正离子CH5+含有10mol电子,所含的电子数为10NA,故B正确;
C.56g铁粉即1mol铁粉在1mol氯气中燃烧,铁粉过量,氯气完全反应,而由于氯气反应后变为-1价,故1mol氯气得2mol电子,则铁粉失去的电子为2mol,即为2NA个,故C错误;
D.0.5mol丙烷中含有4mol碳氢键,含C-H共价键4NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质结构分析,气体摩尔体积的应用条件理解,掌握基础是关键,题目较简单.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题

| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
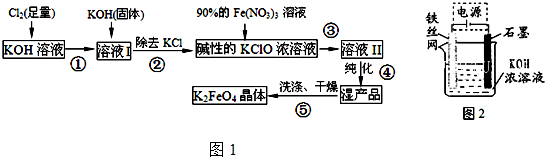
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
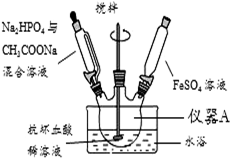 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
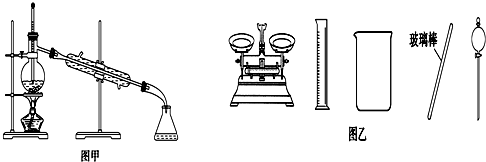
| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com