
| A. | 225mL,5.04L | B. | 150mL,5.04L | C. | 225mL,3.36L | D. | 150mL,3.36L |
分析 发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据n=$\frac{m}{M}$计算Al的物质的量,根据方程式计算消耗NaOH物质的量、生成氢气物质的量,根据V=$\frac{n}{c}$计算需要NaOH溶液体积,根据V=nVm计算氢气体积.
解答 解:4.05g Al的物质的量为$\frac{4.05g}{27g/mol}$=0.15mol,
2 Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2 3
0.15mol x y
所以x=$\frac{0.15mol×2}{2}$=0.15mol,
y=$\frac{0.15mol×3}{2}$=0.225mol,
故需要NaOH溶液最小体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL,
标况下,生成氢气的体积为0.225mol×22.4L/mol=5.04L,
故选:B.
点评 本题考查化学方程式计算,比较基础,明确发生的反应即可解答,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

 2CH3CHO+2H2O
2CH3CHO+2H2O 
 (其中一种)
(其中一种)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
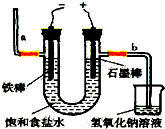 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池工作时,阳离子向负极方向移动 | |
| C. | 反应Cu+2H+=Cu2++H2↑可设计成原电池装置 | |
| D. | 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com