
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:选择题
我国四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。关于该反应的叙述正确的是
A.上述反应中,S和KNO3是氧化剂,C是还原剂
B.上述反应中,每生成1 mollN2需转移6mol电子
C.CO2的摩尔质量为44 g
D.反应中的C若用石墨代替,石墨能导电,但属于非电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高二上学期期中测试化学试卷(解析版) 题型:填空题
化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA nB+pC△H,达到平衡状态.
nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H 0(填“大于”、“小于”或“等于”).
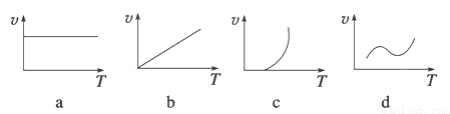
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 (填序号)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1100 |
平衡常数 | 0.68 | 0.50 |
请回答下列问题:
①该反应的△H 0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L﹣1,则温度T (填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1 W2(填“>”、“<”或“=”) .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2+O2 2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
A、增大压强 B、升高温度 C、使用催化剂 D、充入O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
对可逆反应:A(g)+3B(g)  2C(g) ∆H <0,下列叙述错误的是
2C(g) ∆H <0,下列叙述错误的是
A.升高温度平衡逆向移,v(正)、v(逆)都增大,但v(逆)增的更大
B.增大压强平衡正移,v(正)、v(逆)都增大,但v(正)增的更大
C.增大A的浓度平衡正移,v(正)会增大,但v(逆)会减小
D.采用催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:选择题
分子式为C5H10O2并能与碳酸钠反应放出气体的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
某生配制480ml 0.1mol/L的NaOH溶液,下列操作可使所配制溶液的浓度偏大的是
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.移液时,有少量液体溅出
C.定容时,俯视刻度线
D.定容摇匀后发现液面下降,继续加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O ……(a);
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b);
2NaHSO3 Na2S2O5 + H2O ……(c);
Na2S2O5 + H2O ……(c);
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
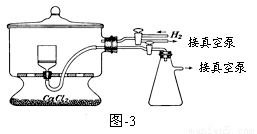
(5)用图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④ 。
⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验现象预测或装置的选用正确的是

A.用装置(Ⅰ)加热草酸晶体的方法获取某些气体(草酸晶体的熔点101.5℃,分解温度约为150℃)
B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产空气污染
D.用装置(Ⅳ)分离溴苯和苯的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com