
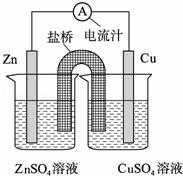
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,铜是正极,自发的氧化还原反应是金属锌和硫酸铜之间的反应,根据原电池的工作原理来回答.
解答:
解:A、将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,故A错误;
B、负极上是金属锌溶解,正极上是金属铜析出,故B错误;
C、铜片是正极,电解质中的阳离子铜离子移向正极,在该极上得电子,析出金属铜,所以Cu片附近Cu2+离子浓度减小,故C正确;
D、电解质中的阳离子铜离子移向正极,盐桥(琼脂﹣饱和KCl溶液)中的K+移向硫酸铜溶液,故D错误.
故选C.
点评:
本题考查学生盐桥原电池的工作原理知识,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.


科目:高中化学 来源: 题型:
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)
2NO(g) 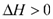
已知该反应在 2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向 2 L 密闭容器中充入 N2 和 O2 各 1 mol,平衡时,N2 的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内 N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_______。
(4)将 N2、O2 的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________。
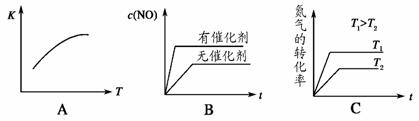
(5)向恒温恒容的密闭容器中充入等物质的量的 N2 和 O2,达到平衡状态后再向其中充入一定量 NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下0.1mol•L﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
|
| A. | 将溶液稀释到原体积的10倍 |
|
| B. | 加入适量的醋酸钠固体 |
|
| C. | 加入等体积0.2 mol•L﹣1盐酸 |
|
| D. | 提高溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)⇌A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )
|
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 |
|
| C. | 反应速率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g),反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.计算:
(1)达到平衡时,消耗N2的物质的量,n(N2)=
(2)原混合气体与平衡混合气体的压强之比(写出最简整数比),p(始):p(平)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X(g)+Y(g)⇌2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,达到平衡时,各物质的浓度不可能是( )
|
| A. | Z为0.3 mol/L | B. | Y为0.15 mol/L |
|
| C. | X为0.1 mol/L | D. | Z为0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应X(g)+Y(g)⇌2Z(g),在相同温度下于四个体积相等的密闭容器内按下列配比进行反应,达到平衡时,Y所占的百分含量最低的是( )
|
| A. | a mol X+a mol Y | B. | 2a mol Z |
|
| C. | a mol X+a mol Z | D. | a mol Y+a mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为某化学反应的速率与时间的关系示意图。保持其他条件不变,在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g) 2HI(g) ΔH>0
2HI(g) ΔH>0
D.2A(g)+B(s) 2C(g) ΔH<0
2C(g) ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com