
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
【答案】C
【解析】解:石墨作电极电解此溶液,当通电一段时间后,两极均收集1.12L气体(标准状况),n(O2)=n(H2)= ![]() =0.05mol, 阳极发生 4OH﹣﹣4e﹣═O2↑+2H2O,
=0.05mol, 阳极发生 4OH﹣﹣4e﹣═O2↑+2H2O,
0.2mol 0.05mol
阴极发生Cu2++2e﹣═Cu、2H++2e﹣═H2↑,
0.05mol 0.1mol 0.1mol 0.1mol 0.1mol 0.05mol
A.电解得到的Cu的物质的量为0.05mol,质量为:64g/mol×0.05mol=3.2g,故A正确;
B.由上述分析可知,电解过程中转移电子总数为:0.05mol×4=0.2mol,故B正确;
C.电解后溶液中氢离子的物质的量浓度为:c(H+)= ![]() =0.4mol/L,故C错误;
=0.4mol/L,故C错误;
D.c(Cu2+)= ![]() =0.2mol/L,由电荷守恒可知,原混合溶液中c(K+)为:0.5mol/L×2﹣0.2mol/L×2=0.6mol/L,故D正确;
=0.2mol/L,由电荷守恒可知,原混合溶液中c(K+)为:0.5mol/L×2﹣0.2mol/L×2=0.6mol/L,故D正确;
故选C.


科目:高中化学 来源: 题型:
【题目】2015年10月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,理由是她发现了青嵩素,并用青嵩素两步合成得到青嵩琥酯,这种药品可以有效降低疟疾患者的死亡率.下列有关说法正确的是( ) 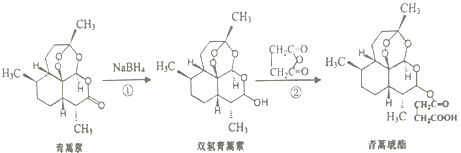
A.青嵩素分子式为C15H23O5
B.青嵩素不能与NaOH溶液反应
C.反应②原子利用率为100%
D.青嵩琥不能与碳酸氢钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( ) 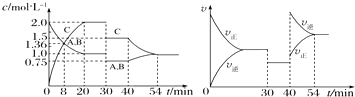
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的反应速率为0.08 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过HNO3酸化的Ba(NO3)2溶液
B.先通过足量品红溶液,再通过澄清石灰水
C.先通过足量NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些气体具有的特征:a.有刺激性气味;b.可与水反应使溶液呈酸性;c.能使淀粉碘化钾溶液变蓝。下列各气体均符合以上全部特征的是( )
A.NO2、SO2B.NH3、NO2C.NO2、Cl2D.Cl2、SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸二丁酯DBP是一种常见的塑化剂,可以乙烯和邻二甲苯为原料合成,合成过程如图所示:
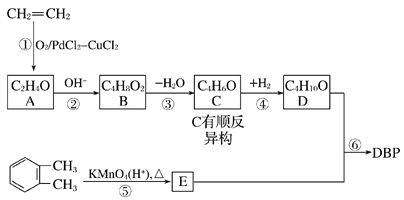
请回答下列问题:
(1)DBP的分子式为________________,C的顺式结构为________________。
(2)B中含有的官能团名称为________________,反应③的类型为________反应。
(3)写出下列反应的化学方程式
反应③______________________________________________________________
反应⑥_______________________________________________________________
(4)E的一种同分异构体F,,苯环上含有两个取代基,能与NaOH溶液反应,且1 mol F完全反应消耗3 mol NaOH,写出F所有可能的结构简式:_______________________________________________________________。
(5)检验C中碳碳双键的方法_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=﹣58 kJmol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是__________________________________________________________(写出两点),缺点是______________________________________________________________________(写出两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
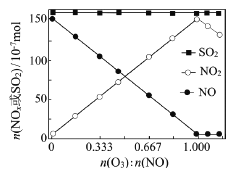
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Se是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为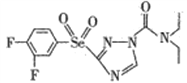 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2的空间构型为________,与SeO3互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
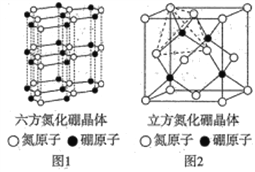
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com