
【题目】下列反应中H2O只做还原剂的是( )
A.2Na+2H2O═2NaOH+H2↑
B.2H2O═2H2↑+O2↑
C.2F2+2H2O═4HF+O2
D.CaO+H2O═Ca(OH)2
科目:高中化学 来源: 题型:
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
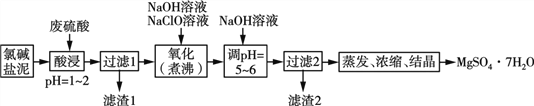
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下8.96 L CH4的质量是__________g,含__________个氢原子。
(2)将标准状况下22.4 L的HCl 溶于水配成200 mL的溶液,所得溶液的物质的量浓度为______________;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是______________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类水解产物或水解过程的叙述中正确的是
A. 所有的糖类都能发生水解反应生成单糖
B. 蔗糖与麦芽糖的水解产物相同
C. 淀粉在人体内直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纤维素都可以水解成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
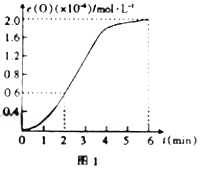
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
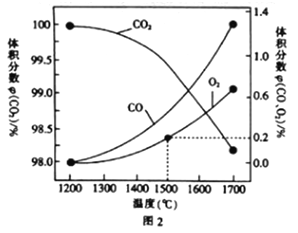
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
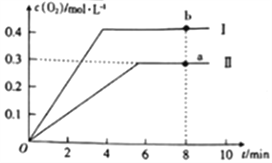
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
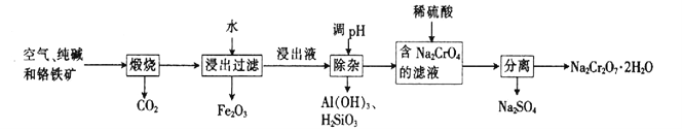
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
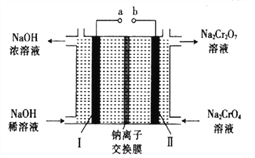
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧美三位科学家因“分子机器的设计与合成”研究而荣获2016年诺贝尔化学奖。纳米分子机器研究进程中常见机器的“车轮”组件如下图所示。下列说法正确的是

A. ①③互为同系物 B. ①②③④均属于烃
C. ①④的一氯代物均为三种 D. ②④互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
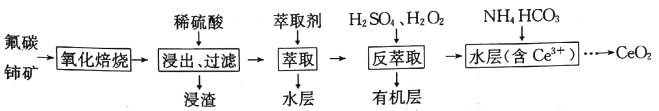 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其所表示的各原子组中能相互结合成AB2型稳定共价化合物的是( )
A.18和12
B.7和8
C.11和16
D.12和9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com