
| A. | ①③⑤⑥⑦ | B. | ②④⑥⑦ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑦ |
分析 ①最高正价为+6价,能与氢形成气态氢化物,说明为非金属元素,最外层有6个电子;
②最外层电子数为1,并且有+1价、+2两种化合价,可能为Cu;
③副族和第VIII族元素的次外层电子没有排满;
④最外层电子数是次外层电子数的3倍,则电子数为8;
⑤最外层电子数为3的一种元素,则最外层电子排布为ns2np1;
⑥能形成气态氢化物的一种元素,说明为非金属元素;
⑧Mn元素的最高价氧化物对应的水化物是酸.
解答 解;①最高正价为+6价,能与氢形成气态氢化物,说明为非金属元素,最外层有6个电子,则为第VIA族元素,是主族元素,故正确;
②最外层电子数为1,并且有+1价、+2两种化合价,可能为Cu,Cu不是主族元素,故错误;
③副族和第VIII族元素的次外层电子没有排满,除最外层外,其余各电子层都达到了饱和,说明为主族元素,故正确;
④最外层电子数是次外层电子数的3倍,则电子数为8,为氧元素,属于主族元素,故正确;
⑤最外层电子数为3的一种元素,则最外层电子排布为ns2np1,为p区元素,属于主族元素,故正确
⑥能形成气态氢化物的一种元素,说明为非金属元素,而稀有气体不能形成气态氢化物,所以属于主族元素,故正确;
⑧Mn元素的最高价氧化物对应的水化物是酸,Mn不是主族元素,故错误.
故选A.
点评 本题考查结构性质位置关系应用,需要学生熟练掌握元素周期表的结构,注意利用列举反例法进行分析解答,题目难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | CuO | H2O | SiO2 | FeCl3 |
| W | H2O | Fe3O4 | CO | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
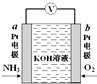 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 负极的电极反应式为:2NH3-6e-+6OH-═N2↑+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 所加试剂 | 主要操作 |
| 除去NaCl溶液中混有的I2 | 苯或四氯化碳 | 萃取、分液 |
| 除去NO气体中混有的NO2 | 水 | 洗气 |
| 除去SiO2固体中混有的Al2O3 | 盐酸 | 过滤 |
| 除去Fe2(SO4)3溶液混有的FeSO4溶液 | 过氧化氢 | ------ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
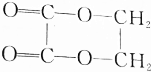 的化学方程式(无机试剂任选)并注明反应类型.
的化学方程式(无机试剂任选)并注明反应类型. (取代反应).
(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
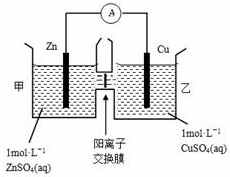
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com